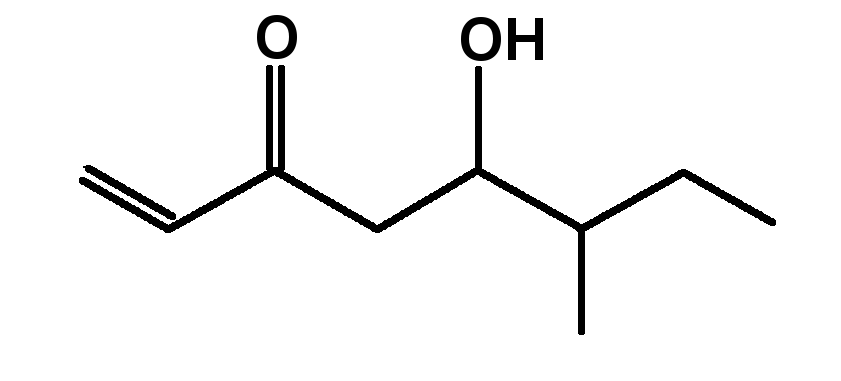
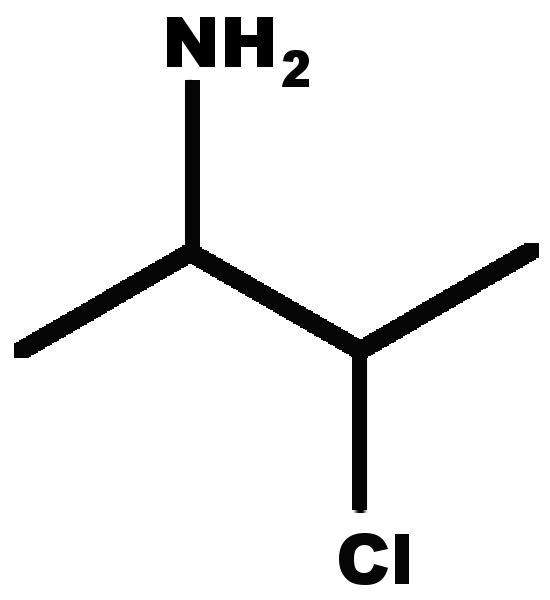
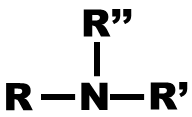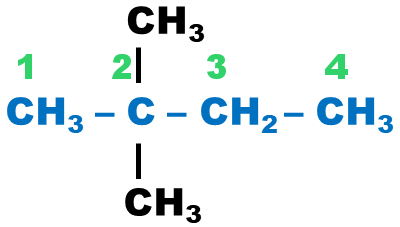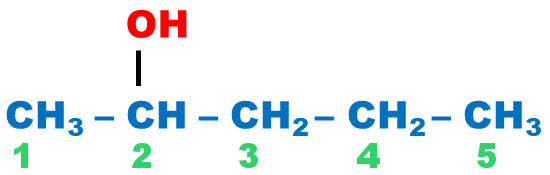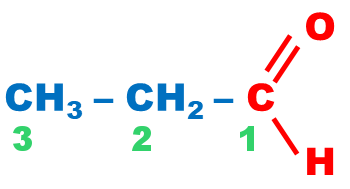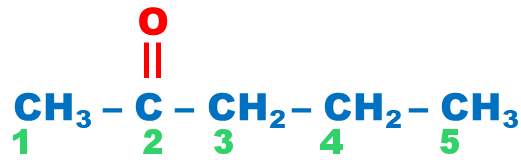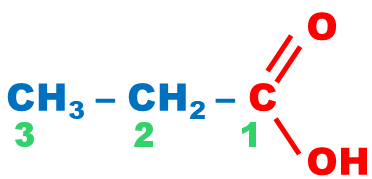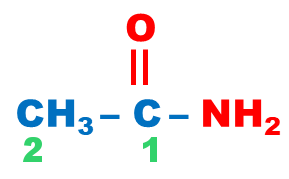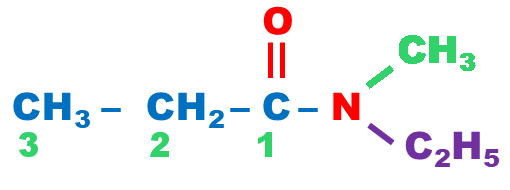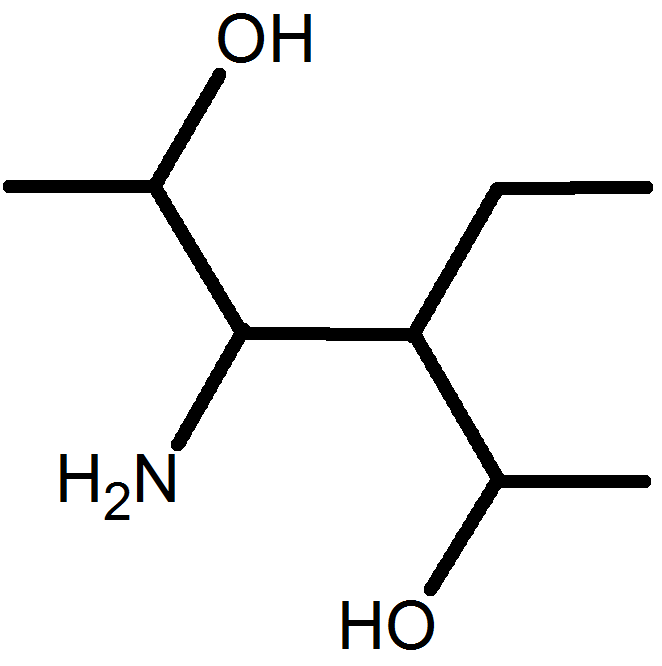Nomenclature
NOMENCLATURE DES MOLECULES ORGANIQUES
A Molécules organiques
A1 Constitution des molécules organiques
Une molécule organique est une molécule qui contient majoritairement des atomes de carbone (C).
Les autres principaux atomes constitutifs sont l'hydrogène (H), l'oxygène (O) et l'azote (N).
A2 Structures des atomes constitutifs
| Atome | Schéma | Représentation de Lewis | Structure électronique |
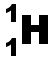 |
 |
 |
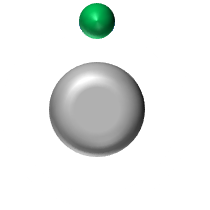
(K)1 L'atome d'hydrogène doit acquérir 1 électron pour obtenir la structure stable du duet. Il pourra donc former 1 liaison covalente. |
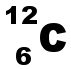 |
 |
 |
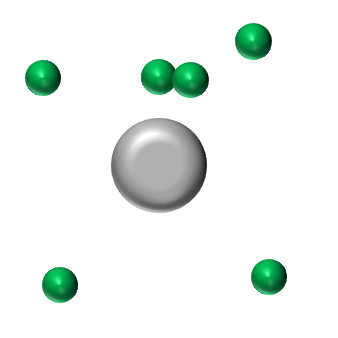
(K)2(L)4 L'atome de carbone doit acquérir 4 électrons pour obtenir la structure stable en octet. Il pourra donc former 4 liaisons covalentes. |
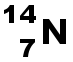 |
 |
 |
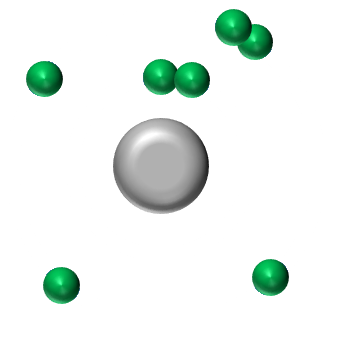
(K)2(L)5 L'atome d'azote doit acquérir 3électrons pour obtenir la structure stable en octet. Il pourra donc former 3 liaisons covalentes. |
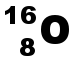 |
 |
 |
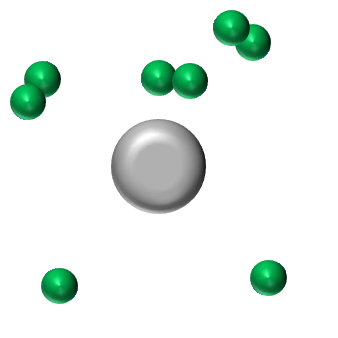
(K)2(L)6 L'atome d'oxygène doit acquérir 2 électrons pour obtenir la structure stable en octet. Il pourra donc former 2 liaisons covalentes. |
B Les familles de molécules organiques
Certains groupements d’atomes se retrouvent dans de nombreuses molécules organiques et leur confèrent des propriétés chimiques particulières : ce sont les groupes caractéristiques.
Les molécules organiques comportant le même groupe caractéristique forment une famille.
| Famille /Fonction | Groupe caractéristique | Formule générale | ||
| Alcane | Liaisons simples | 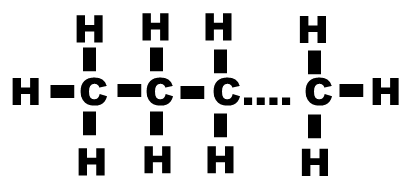 |
CnH2n+2 (liaisons simples entre les atomes de carbone). L’alcane peut être ramifié. |
|
| Alcène | Liaison(s) double(s) |  |
CnH2n (présence d’une liaison double entre au moins deux atomes de carbone) |
|
| Alcyne | Liaison(s) triple(s) |  |
CnH2n-2 (présence d’une liaison triple entre au moins deux atomes de carbone) |
|
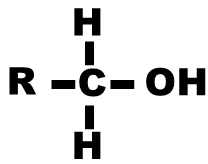
| Alcool |
hydroxyle |
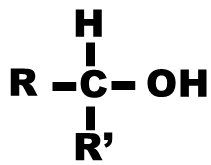
Alcool primaire : le carbone portant le groupement hydroxyle n’est relié qu’à un seul autre atome de carbone |
Alcool secondaire : le carbone portant le groupement hydroxyle est relié à deux autres atomes de carbone. |
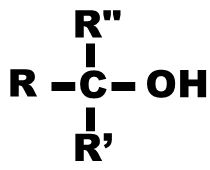
Alcool tertiaire : le carbone portant le groupement hydroxyle est relié à trois autres atomes de carbone. |
| Etheroxyde |
oxy |
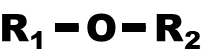 |
Les éthers sont composés de deux chaînes carbonées, séparées par un atome d'oxygène. | |
| Acide carboxylique |
carboxyle |
 |
||
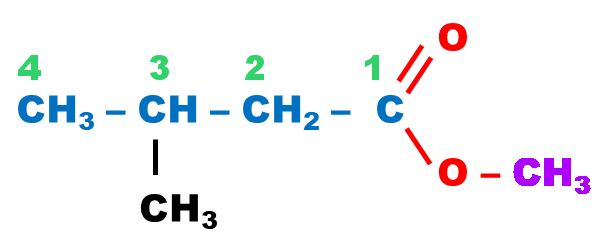
| Ester |
ester |
 |
||
| Aldéhyde |
carbonyle |
 |
||
| Cétone |  |
|||
| Amide | 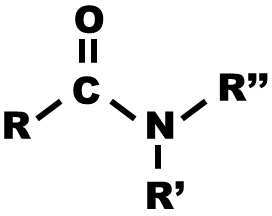 |
Les amides sont caractérisés par la présence d'un groupe carbonyle lié à un atome d'azote. | ||
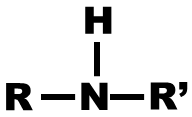
| Amine |
amino |
Amine Primaire : l’atome d’azote est relié à un seul atome de carbon |
Amine Secondaire : l’atome d’azote est relié à deux autres atomes de carbone |
Amine Tertiaire : l’atome d’azote est relié à trois autres atomes de carbone |
| Composés halogénés |
( - F ; - Cl ; - Br ; - I) |
|||
C Donner un nom à une molécule
Les règles officielles de nomenclature sont fixées par l’Union Internationale de Chimie Pure et Appliquée (UICPA, IUPAC en anglais). Elles permettent de donner sans ambiguïté un nom à une molécule.
C1 Nommer un hydrocarbure
Les hydrocarbures sont constitués exclusivement d'atomes de carbone (C) et d'hydrogène (H).
Ils peuvent être saturés (comportant uniquement des liaisons simples entre les atomes de carbone) ou insaturés (comportant au moins une liaison double ou triple).
Certaines molécules sont cycliques et d’autres à chaîne ouverte. Ces dernières peuvent être linéaires (constituées d’une seule chaîne ouverte) ou ramifiées (constituées au moins deux chaînes ouvertes). Un alcane ramifié est formé d’une chaîne principale (correspondant au plus long enchaînement linéaire d’atomes de carbone dans la molécule) portant des substituants alkyles (notés -R).
Le nom des hydrocarbures est composé d'un radical (préfixe) indiquant le nombre d'atomes de carbone de la chaîne principale et d’un suffixe précisant le groupe fonctionnel.
|
|
|
Terminaison des molécules acycliques |
Molécules cycliques |
||
|
Nombre de C |
Préfixe |
Alcanes (liaison simple) -ane |
Alcènes (liaison double) -ène |
Alcynes (liaison triple) -yne |
cyclo……. |
|
1 |
méth |
|
|
|
|
|
2 |
éth |
|
|
|
|
|
3 |
prop |
|
|
|
|
|
4 |
but |
|
|
|
|
|
5 |
pent |
|
|
|
|
|
6 |
hex |
|
|
|
|
|
7 |
hept |
|
|
|
|
|
8 |
oct |
|
|
|
|
|
9 |
non |
|
|
|
|
|
10 |
déc |
|
|
|
|
|
11 |
undéc |
|
|
|
|
|
12 |
dodéc |
|
|
|
|
Cas de deux ramifications identiques : on ajoute le préfixe « di » avant le nom du substituant et on sépare les indices de positions par une virgule. |
2,2-diméthylbutane |
|
pentan-2-ol |
|
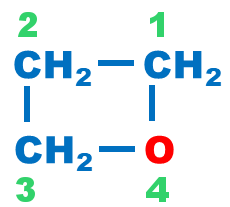
Éthers non cycliques : par rapport à l'oxygène central, la chaîne alkyle la plus longue est utilisée en suffixe et l'autre chaîne en préfixe de type alcoxy. |
méthoxypropane |
| Éthers cycliques : on utilise le nom qu'aurait un alcane cyclique si l'on remplaçait l'oxygène de l'éther par un carbone, et on rajoute le préfixe « oxa ». |
oxycyclobutane |
|
propanal |
|
La démarche est la même que celle utilisée pour l’alcool, sauf que la terminaison du composé est « one ».? |
pentan-2-one |
|
La démarche est la même que celle utilisée pour l’aldéhyde, sauf que le nom du composé est précédé du mot « acide » et la terminaison est « oïque ». |
acide propanoïque |
|
3-méthylbutanoate de méthyle |
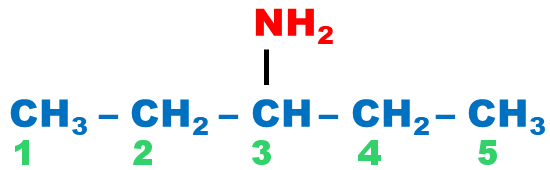
| La démarche est la même que celle utilisée pour l’alcool, sauf que la terminaison « ol » est remplacée par la terminaison « amine ». |
pentan-3-amine |
|
On obtient le nom d’un amide primaire à partir du nom de l’acide carboxylique correspondant R–COOH, en remplaçant la terminaison « oïque » par la terminaison « amide ». |
éthanamide |
| Dans le cas des amides secondaires et tertiaires, on énonce d’abord les groupes substituants sur l’azote du groupe –NH2, dans l’ordre alphabétique, précédés de la lettre N puis du nom de l’acide correspondant R–COOH dans lequel on remplace la terminaison « oïque » par la terminaison « amide ». |
N-éthyl-N-méthylpropanamide |
|
La démarche est la même que celle utilisée pour l’aldéhyde, sauf que le nom du composé est précédé du mot « acide » et la terminaison est « oïque ». |
acide propanoïque |
|
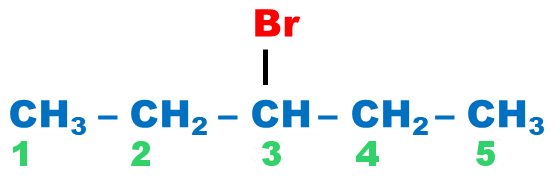
Dans ce cas, l'halogène est considéré comme un "substituant" : On rajoute le préfixe n – chloro (fluoro, bromo, iodo) en précisant la position de l'halogène dans la chaîne principale. |
3-bromopentane |
D Méthode pour nommer une molécule organique
D1 Etape 1 :
- Rechercher les différentes fonctions contenues dans la molécule.
- Définir la fonction pincipale d'après les règles de priorité ci-dessous :

D2 Etape 2 :
- Attribuer un terme à chaque fonction suivant qu'il s'agit de la fonction principale ou pas (substituant).
|
Famille |
Alcane |
Alcène |
Alcyne |
Alcool |
Acide carboxylique |
Ester |
Aldéhyde |
Cétone |
Amide |
Amine |
|
Fonction principale |
-ane |
-ène |
-yne |
-ol |
-oïque |
|
-al |
-one |
-amide |
-amine |
|
Fonction secondaire |
|
|
|
hydroxy |
carboxy |
oxocarbonyl |
oxo ou formyl |
oxo |
carbamoyl |
amino |
Recenser les insaturations : cycles, C = C , $C \equiv C$ .
- S'il n'y a pas d'insaturations, le nom fera intervenir le substantif " – an – " avant la terminaison de la fonction principale.
- S'il y a des liaisons doubles, le nom fera intervenir le substantif " – én – " avant la terminaison de la fonction principale.
- S'il y a des liaisons triples, le nom fera intervenir le substantif " –yn – " avant la terminaison de la fonction principale.
- Définir la chaîne carbonée la plus longue contenant la fonction principale et le maximum d'instaurations.
- Nommer cette chaîne.
- Repérer les ramifications. Elles seront considérées comme des subsituants. Leur terminaison est "yl ".
Numéroter la chaîne principale.
Cette numérotation permet d’attribuer à la fonction principale, aux insaturations et aux substituants dont les ramifications, des indices permettant de les localiser.
La numérotation est effectuée, en commençant par une extrémité, de telle sorte que la fonction principale ait le plus petit indice possible.
Si 2 numérotations sont possibles, il faut que les insaturations (s’il y en a) soient mises entre des carbones de plus petit numéro.
Si 2 numérotations sont encore possibles, il faut que la somme des indices relatifs aux substituants soit la plus petite possible.
D7 Etape 7 :
Construire le nom.
Remarque :
- Une lettre et un chiffre sont séparés par un tiret.
- Deux chiffres sont séparés par une virgule.
- On ne prend pas en compte les préfixes multiplicatifs pour le classement alphabétique.
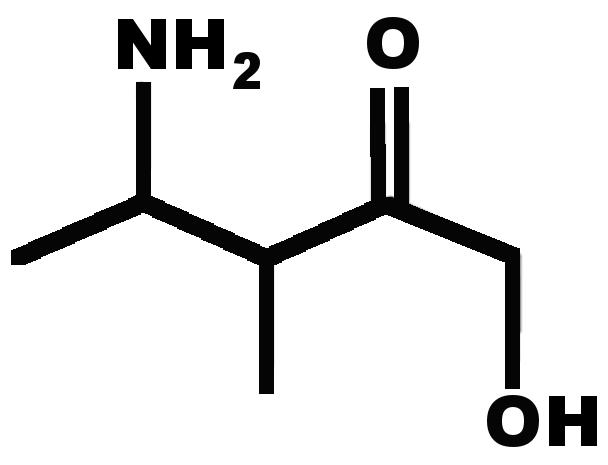
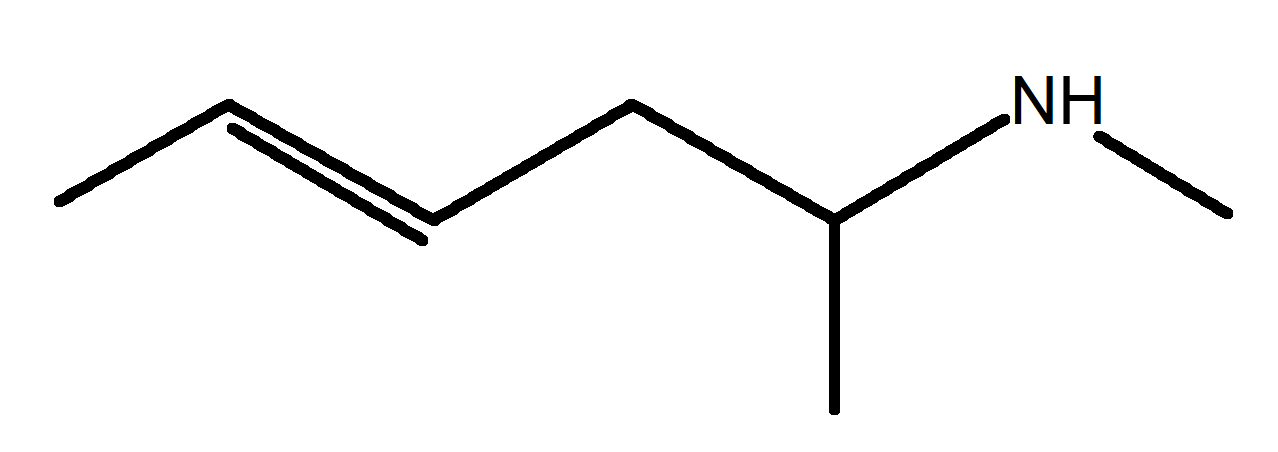
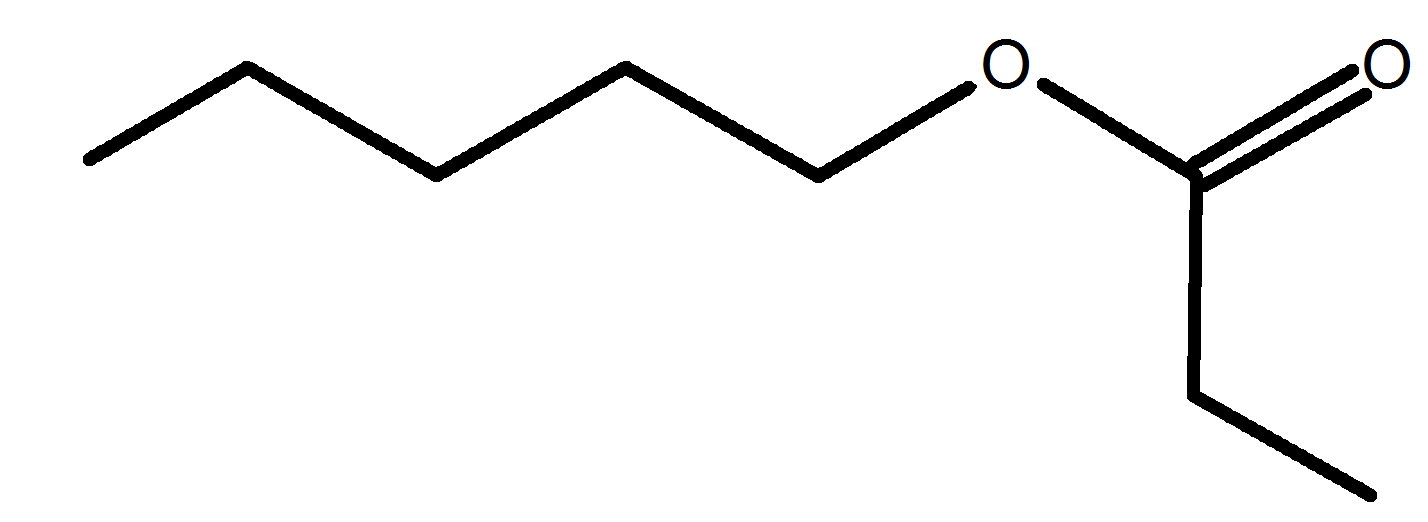
E A vous de jouer !
E1 Nommer une molécule représentée.
E2 représenter une molécule citée.
|
1 |
2,2-diméthylbutane |
|
|
2 |
2-éthyl-3-méthylpent-1-ène |
|
|
3 |
3-méthyl-2-propylhexanal |
|
|
4 |
2,4-diméthylpentan-3-one |
|
|
5 |
Acide 4-méthylpentanoïque |
|
|
6 |
3-méthylbutan-2-amine |
|
|
7 |
Triméthylamine |
|
|
8 |
2-méthlylpropanoate de propyle |
|
|
9 |
Acide 3-amino-4-méthylhex-4-énoïque |
|
|
10 |
2-(1-chloréthyl)cyclohexanone |
Commentaires
-

- 1. Alexis Le 09/09/2024
J'ai beaucoup apprécié ce petit cours, qui aide alors à rappeler les bases même à l'université !-

- bob_coyoteLe 14/09/2024
Merci ! Bonnes études !
Ajouter un commentaire