Description microscopique de la matière
ACTIVITES
A1. Les entités chimiques.
Certains corps ne conduisent pas le courant électrique, d'autres peuvent et d'autres encore le conduisent très bien. L'électricité fait partie de la vie courante. Elle est transportée par des fils électriques constitués de cuivre.
La matière est-elle constituée des mêmes entités ?
|
|
|
Doc 3 : Expérience.
|
|
Doc 4 : A disposition. $\bullet$ Un générateur. $\bullet$ Une cuve à électrolyse. $\bullet$ Un ampèremètre. $\bullet$ Des fils électriques en cuivre $Cu$. $\bullet$ De l'eau distillée $H_2O$. $\bullet$ Une solution contenant du sucre de formule $C_{12}H_{22}O_{11}$ (saccharose) dissout dans de l'eau distillée. $\bullet$ Une solution ionique de sulfate de cuivre $\left ( Cu^{ \ 2+}_{(aq)} \ + \ SO^{ \ 2-}_{4(aq)} \right )$ dissout dans de l'eau distillée. |
|
Doc 5 : Etymologie.
|
A11. Réaliser.
$\bullet$ Réaliser le montage ci-dessus.
$\bullet$ Compléter la cuve successivement avec chacune des solutions à disposition.
$\bullet$ Mesurer l'intensité électrique et reporter les mesures dans le tableau ci-dessous :
|
Solution |
Intensité (A) |
|
Eau distillée |
|
|
Saccharose dissout |
|
|
Sulfate de cuivre dissout |
A12. Analyser / Valider.
$\bullet$ Pour chaque montage, décrire chaque composant.
A13. Observer / Valider.
$\bullet$ Pour le dernier montage, observer la surface des électrodes. Expliquer.
$\bullet$ A l'aide du dernier document, et des résultats obtenus avec le saccharose et le cuivre. Expliquer la différence probable entre le comportement de ces deux espèces et tenter d'expliquer.
A14. Conclusion.
$\bullet$ Expliquer la différence vis-à-vis de leur propriété électrique.
A2. L'atome de carbone.
L'existence de l'atome est admise depuis la fin du XIXème siècle. On n'a pu le visualiser qu'à la fin du XXème siècle.
Quels sont les ordres de grandeur de la masse et de la taille d'un atome ?
|
Doc 1 : Constitùtion de l'atome de carbone.
|
|
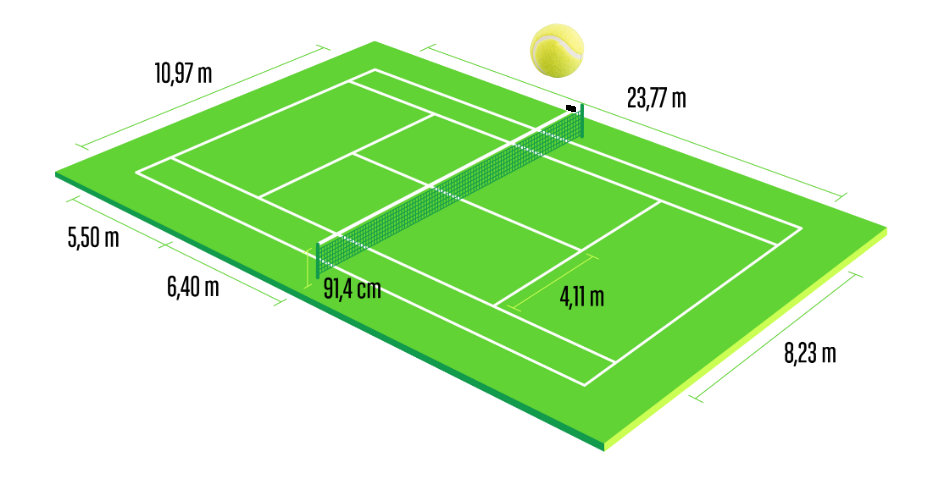
Doc 2 : L'atome et le tennis.
|
|
Doc 3 : Caractéristiques des particules élémentaires.
|
|
Doc 4 : Comparer deux nombres. Il est très utile de comparer deux grandeurs afin de savoir s'il est nécessaire de toutes les considérer dans les études physiques. Pour comparer deux grandeurs A et B, on effectue le rapport de l'une à l'autre : $\dfrac{A}{B}$ . $\bullet$ Si $\dfrac{A}{B} \ > \ 1$ , la valeur A est plus grande que la valeur B. $\bullet$ Si $\dfrac{A}{B} \ < \ 1$ , la valeur A est plus petite que la valeur B. $\bullet$Généralement : - On négligera une grandeur B devant une grandeur A quand $\dfrac{A}{B} \ > \ 100$ - On négligera une grandeur A devant une grandeur B quand $\dfrac{A}{B} \ < \ \dfrac{1}{100}$ |
A21. Analyser.
$\bullet$ En utilisant le lien fourni dans le doc 1., dénombrer les quantités de chaque particule élémentaire constituant l'atome de carbone.
$\bullet$Ecrire la notation conventionnelle de l'atome de carbone.
A22. Raisonner.
A22a. Taille.
$\bullet$ A l'aide du doc 2, déterminer l'ordre de grandeur de la taille d'un atome.
$\bullet$ A l'aide des doc 2 et 4, comparer la taille de l'atome à celle de son noyau.
A22b. masse.
$\bullet$ Déterminer la valeur de la masse du noyau de l'atome de carbone.
$\bullet$ Déterminer la valeur de la masse du cortège électronique de l'atome de carbone.
$\bullet$ Comparer ces deux valeurs et conclure.
A22b. charge.
$\bullet$ Déterminer la valeur de la charge de l'atome de carbone. Expliquer.
A3. La mole, unité de quantité de matière.
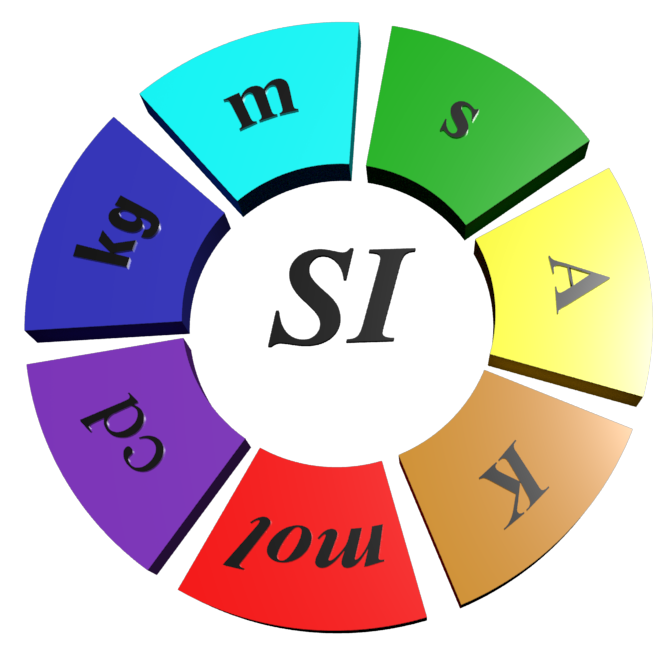
Fin de l'année 2018 à Versailles, la conférence générale des poids et mesures a adopté une révision du Système international des unités.
Quelles en sont les conséquences ?
A31. Définition.
|
Doc 1 : Le système international d'unités (SI).
|
|
Doc 2 : Le kilogramme.
|
.
|
Doc 3 : Doc3 : Evolution de la définition de la mole.
|
$\bullet$ Pourquoi existait-il une incertitude sur la valeur du kilogramme dans son ancienne définition ?
$\bullet$ Quel problème cela posait-il sur la définition de la mole datant de 1971 ?
$\bullet$ Comment la nouvelle définition de la mole a elle résolu le problème ?
A32. Raisonner.
On donne un extrait la classification périodique des éléments :
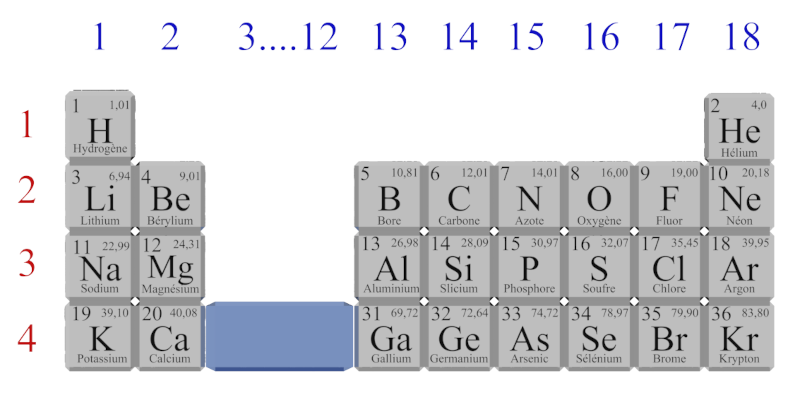
A32a. La masse molaire atomique.
$\bullet$ En utilisant les données du doc3 de l'activité préciser où se trouve la valeur utilisée pour la définition de la mole de 1971.
$\bullet$ En utilisant le doc3 de l'activité précédente, rappeler la valeur de la masse de l'atome de carbone.
$\bullet$ Calculer alors le nombre d'entités présentes dans $12,00 \ g$ de carbone 12, $^{12 \ }_{6 \ }C$. Conclure.
$\bullet$ Calculer la masse de l'atome de phosphore $^{31 \ }_{15 \ }P$.
$\bullet$ Calculer le nombre d'entités présentes dans $30,97 \ g$ de phosphore $^{31 \ }_{15 \ }P$.
$\bullet$ Conclure pour tous les éléments de la classification et définir la masse molaire atomique.
A32b. La masse molaire moléculaire.
$\bullet$ Donner la masse molaire atomique de l'hydrogène et de l'oxygène.
$\bullet$ Une molécule d'eau $H_2 O$ étant constituée de deux atomes d'hydrogène $H$ et d'un atome d'oxygène $O$, la masse molaire moléculaire de l'eau est constituée de la masse molaire de tous les atomes la constituant. Calculer la masse molaire moléculaire de l'eau.
$\bullet$ Compléter le tableau ci-dessous :
|
Molécule |
Détail du calcul |
Masse molaire moléculaire ($g.mol^{ \ -1}$) |
|
Méthane $CH_4$ |
|
|
|
Méthanone $CH_2O$ |
||
|
Ethanamine $C_2H_7N$ |
$\bullet$ Déterminer la quantité de matière contenue dans 1 L d'eau.
Exercices P49 à 53 : 13 ; 14 ; 15 ; 16 ; 17 ; 27 ; 28 ; 29 ; 30 ; 32 ; 43.
Exercices P73 à 77 : 28 ; 31 ; 35 ; 36 ; 45.
COURS
C1. La matière et l'atome.
C11. Définition.
|
La matière qui nous entoure se présente sous différents aspects. Elle peut être solide, liquide ou gazeuse. Elle est constituée de particules infiniment petites, invisibles à l'œil nu l'atome qui s'associent sa taille est de l'ordre de l'Angström ($ 1 \ \overset{ o }{ A} \ = \ 10^{ \ -10} \ m$) L'atome n'est pas une particule indissociable, il est lui-même formé de particules encore plus petites, les protons, les neutrons se regroupant dans un noyau, lui-même entouré d'un nuage formé d'électrons. Les atomes s'associent pour former des molécules. Les propriétés des corps formés par ces associations sont différentes selon ces arrangements. La matière n'a pas de charge électrique : sa charge électrique est nulle. |
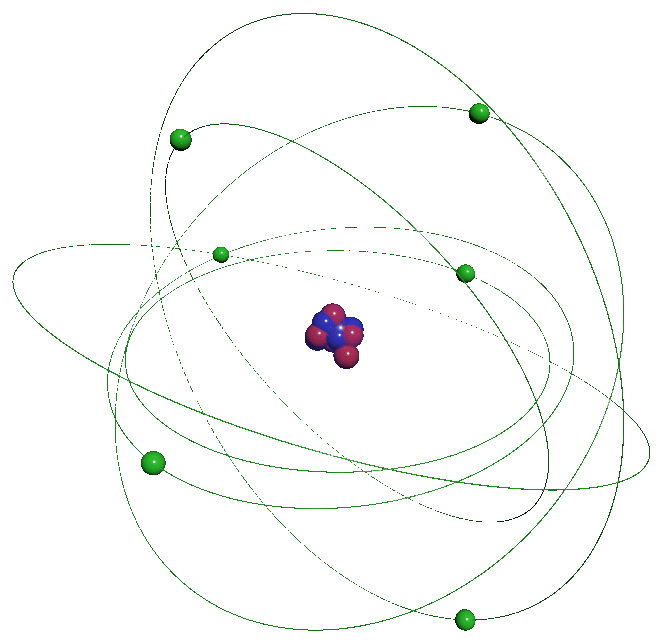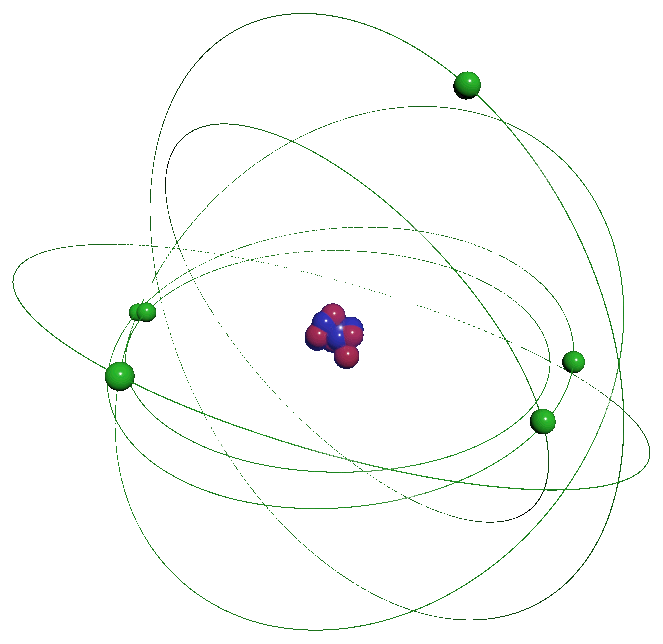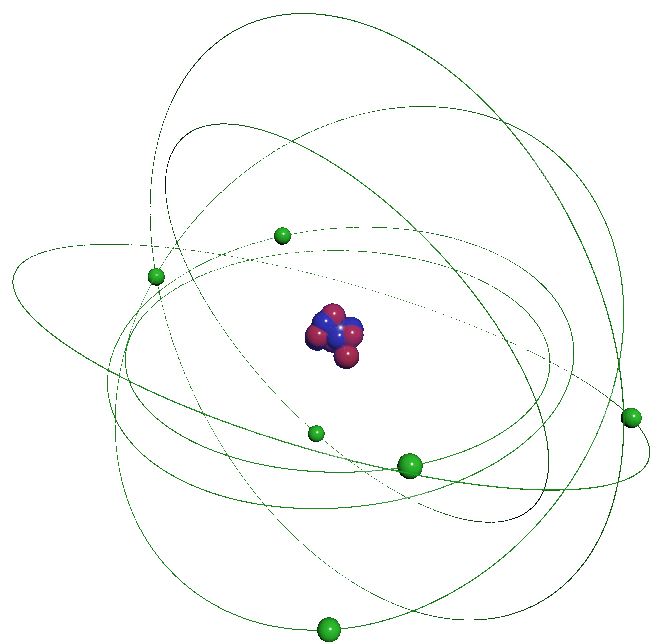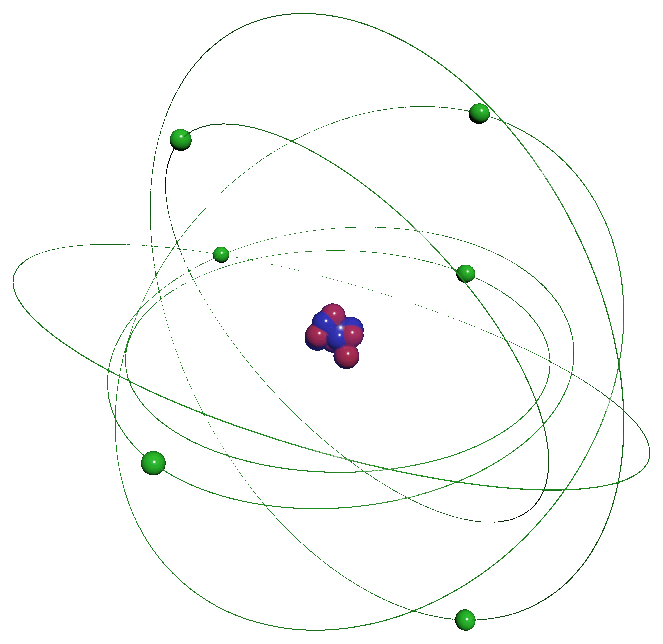 |
C12. Classement.
Chaque atome a des particularités qui lui sont propres.
Au fil du temps, de nouveau matériaux ont été découverts.
Une fois la notion d'atome acquise et reconnue par les scientifiques, ils les ont "classés" dans un tableau.
Le tableau de la "classification périodique des éléments" établi par Dmitri Mendeleïev (1834 – 1907) regroupe tous les types d'atomes.
Chaque atome est associé à l'ELEMENT correspondant.

Classification périodique des éléments.
C13. Description.
C13a. Constituants :
L'atome est constitué de particules élémentaires :
$\bullet$ D'un noyau contenant les nucléons : les neutrons et les protons.
$\bullet$ D'un cortège électronique constitué d'électrons contenu dans le "nuage électronique".
|
Particule |
Electron ($e^{ \ -}$) |
Proton (p) |
Neutron (n) |
|
Masse (kg) |
$m(e^{ \ -}) \ = 9,109.10^{ \ -31}$ |
$m(p) \ = 1,673.10^{ \ -27}$ |
$m(n) \ = 1,675.10^{ \ -27}$ |
|
Charge (C) |
$q(e^{ \ -}) \ = \ - \ 1,602.10^{ \ -19}$ |
$q(p) \ = \ + \ 1,602.10^{ \ -19}$ |
$q(n) \ = \ 0$ |
Le noyau de l'atome correspondant à l'élément $X$ est noté : $^{A \ }_{Z \ }X$, contenant :
$\bullet$ A nucléons dont Z protons et A – Z neutrons.
$\bullet$ Z électrons.
C13b. Electroneutralité.
|
La charge électrique du neutron est nulle. L'atome contenant autant de protons (Z) que d'électrons (Z) de charges opposées : La charge de l'atome est nulle : $Q \left (^{A \ }_{Z \ }X \right ) \ = \ 0 \ C$ |
Exemple :
$\bullet$ Considérons un atome d'oxygène $^{16 \ }_{8 \ }O$.
$Q \left ( ^{16 \ }_{8 \ }O \right ) \ = \ 8 \times q(p) \ + \ (16-8) \times q(n) \ + \ 8 \times q(e^{ \ -})$.
$Q \left ( ^{16 \ }_{8 \ }O \right ) \ = \ 8 \times 1,602.10^{ \ -19} \ + \ (16-8) \times 0\ - \ 8 \times 1,602.10^{ \ -19}$.
$Q \left ( ^{16 \ }_{8 \ }O \right ) \ = \ 0 \ C$.
C13b. Masse.
La masse d'un atome $^{A \ }_{Z \ }X$ est constituée des masses de toutes les particules le constituant :
Exemple :
$\bullet$ Considérons un atome d'oxygène $^{16 \ }_{8 \ }O$.
$m \left (^{\color{red}{16 \ }}_{\color{blue}{8 \ }} O \right ) \ = \ \color{blue}{8 \ } \times \ 1,673.10^{ \ -27} \ + \ \left ( \color{red}{16} \ - \ \color{blue}{8} \right ) \times \ 1,675.10^{ \ -27} \ + \ \color{green}{8 \ } \times \ 9,109.10^{ \ -31} $.
$m \left (^{\color{red}{16 \ }}_{\color{blue}{8 \ }} O \right ) \ = \ \color{blue}{2,678.10^{ \ -26}} \ + \ \color{green}{7,287.10^{ \ -30}}$
$\color{red}{m \left ( ^{16 \ }_{8 \ } O \right ) \ = \ 2,679.10^{ \ -26} \ kg}$.
$\bullet$ Comparons cette masse à celle des électrons le composant :.
$\dfrac{\color{blue}{m(noyau)}}{\color{green}{m(electrons)}} \ = \ \dfrac{\color{blue}{2,678.10^{ \ -26}}}{\color{green}{7,287.10^{ \ -30}}} \ = \ 3675 \ >> \ 1$
La masse du noyau est 3675 fois plus grande que celle des électrons.
Remarque IMPORTANTE :
La masse totale des électrons étant négligeable comparée à celle du noyau, on assimile la masse de l'atome à celle de son noyau.
|
$m \left ( ^{A \ } _{Z \ }X \right ) \ = \ Z \ \times \ m(p) \ + \ (A-Z) \ \times\ m(n)$
|
C13. Association des atomes.
C13a. Espèces moléculaires.
Les atomes s'associent pour former des molécules.
Chaque atome étant électriquement neutre, la matière est électriquement neutre.
Exemples :
$\bullet$ Une molécule d'eau $H_2O$ est formée de deux atomes d'hydrogène $H$ et d'un atome d'oxygène $O$.
$\bullet$ Une molécule de méthane $CH_4$ est formée d'un atome de carbone $C$ et de quatre atome d'hydrogène $H$.
C13b. Espèces ioniques.
Les atomes s'associent aussi pour former des ions.
Un ion monoatomique est un atome ayant perdu ou gagné un ou plusieurs électrons.
L'ion est donc électriquement chargé.
$\bullet$ Un atome ayant perdu un (ou plusieurs électrons) devient chargé positivement.
C'est un CATION.
Exemples :
L'ion sodium $Na^{ \ +}$ (atome de sodium ayant perdu 1 électron).
L'ion calcium $Ca^{ \ 2+}$ (atome de calcium) ayant perdu 2 électrons).
$\bullet$ Un atome ayant gagné un (ou plusieurs électrons) devient chargé négativement.
C'est un ANION.
Exemples :
L'ion chlorure $Cl^{ \ -}$ (atome de chlore ayant gagné 1 électron).
L'ion sulfure $S^{ \ 2-}$ (atome de soufre) ayant gagné 2 électrons).
C2. La mole.
C21. Définition.
|
Les particules constituant la matière étant infiniment petites et taille et en masse, il est impossible d'exprimer leur quantité individuellement. On a regroupé ces entités en "paquet". Ce paquet est appelé "la mole". Une mole d'entités contient $\cal N _a \ = \ 6,02.10^{ \ 23}$ entités toutes identiques (nombre d'Avogadro). |
Exemple :
$\bullet$ Une mole d'atomes de carbone $^{12 \ }_{6 \ }C$ contient $\cal N _a \ = \ 6,02.10^{ \ 23}$ atomes de carbone $^{12 \ }_{6 \ }C$.
$\bullet$ Une mole de molécules d'eau $H_2O$ contient $\cal N _a \ = \ 6,02.10^{ \ 23}$ molécules d'eau $H_2O$.
$\bullet$ Une mole d'ions calcium $Ca^{ \ 2+}$ contient $\cal N _a \ = \ 6,02.10^{ \ 23}$ ions calcium
C22. La masse molaire.
Définition :
|
La masse molaire M d'une entité correspond à la masse d'une mole de cette entité. Elle s'exprime en gramme par mole ($g.mol^{ \ -1} \ ou \ g/mol$).
|
C22a. Masse molaire atomique.
|
La masse molaire atomique correspond à la masse d'une mole de cet élément. Elle indiquée "en haut à droite" de la case correspondant à cet élément dans la classification périodique des éléments. Dans l'exemple ci-contre, la masse molaire atomique du carbone est : $M(C) \ = \ 12,00 \ g.mol^{ \ -1}$ |
 |
C22b. Masse molaire moléculaire.
|
La masse molaire moléculaire correspond à la masse d'une mole de cette molécule. Elle est égale à la somme des tous les éléments constituant cette molécule. Dans l'exemple ci-dessus, la masse molaire moléculaire de l'eau ($H_2O$) a pour valeur : $M(H_2O) \ = \ 2 \ \times M(H) \ + \ 1 \ \times 1 \ M(O)$ $M(H_2O) \ = \ 2 \ \times 1,00 \ + \ 1 \ \times 1 \ 16,00$ $M(H_2O) \ = \ 18,00 \ g.mol^{ \ -1}$ |
 |
C23. Relation masse molaire / quantité de matière.
En notant n la quantité de matière, M la masse molaire et la masse de l'entité A considérée :
$n(A) \ = \ \dfrac {m(A)}{M(A)}$
n est exprimée en mole (mol)
m est exprimée en gramme (g)
M est exprimée en gramme par mol ($g.mol^{ \ -1} \ ou \ g/mol$)
Exemple :
Dans le cas de l'eau $H_2O$.
La masse molaire moléculaire de l'eau est :
$M(H_2O) \ = \ 2 \times M(H) \ + \ 1 \times M(O) \ = \ 2 \times 1,00 + 1 \times 16 \ = \ 18,00 g.mol^{ \ -1}$
$\bullet$ 1 g d'eau contient : $n \ = \ \dfrac{m(eau)}{M(eau)} \ = \ \dfrac{1,00}{18,00} \ = \ 5,56.10^{ \ -2} \ mol$ d'eau.
$\bullet$ La masse de $3,00.10^{ \ -3} \ mol$ d'eau est : $m(eau) \ = \ n(eau) \ \times \ M(eau) \ = \ 3,00.10^{ \ -3} \ \times 18,00 \ = \ 54,00 \ g$.
Ajouter un commentaire