Transformation Chimique
ACTIVITES
A1. Randonnée.
Vendredi soir, Gérard doit préparer des sandwiches pour la randonnée du lendemain au Cirque de la Solitude avec un point culminant à 2100 m.
Combien de sandwiches pourra-t-il préparer ?
|
Doc 1 : Situation
|
|
Doc 2 : Notations. $\bullet$ F la portion de fromage. $\bullet$ P la tranche de pain de mie. $\bullet$ T la tranche de saumon fumé. $\bullet$ S le sandwich complétement réalisé. |
|
Doc 3 : "Le tableau d'avancement" L'avancement x d'une réaction chimique, exprimé en mole correspond à la quantité de produit formé avec un coefficient stœchiométrique égal à 1 A partir d'une quantité de matière initiale $n_0$, pour un avancement x et un coefficient stœchiométrique égal à a, la quantité de matière restante, pour un avancement x est : $n_0 \ - \ a \times x$. $$ \begin{array}{|c|c|c c c c c|} \hline Etat & Avc^t & \color{blue}{\textbf{2}} \ C_2H_{6,(g)} \ \ + & \color{red}{\textbf{7}} \ O_{2,(g)} \ & \overleftarrow{\longrightarrow} & \color{green}{\textbf{4}} \ CO_{2,(g)} \ + & \color{magenta}{\textbf{6}} \ H_2O_{(l)} \\ \hline initial & x=0 & n_{1} & n_{2} & & 0 & 0 \\ \hline \hline instant t & x & n_{1} - \color{blue}{\textbf{2}} x & n_{2} - \color{red}{\textbf{7}} \times x & & \color{green}{\textbf{4}} \times x & \color{magenta}{\textbf{6}} \times x \\ \hline \hline final & x_{f} & n_{1}- \color{blue}{\textbf{2}} \times x_f & n_{2} - \color{red}{\textbf{7}} \times x _f & & \color{green}{\textbf{4}} \times x_f & \color{magenta}{\textbf{6}} \times x_f \\ \hline \end{array} $$ |
A11. Etude simplifiée.
$\bullet$ Compléter le tableau ci-dessous :
|
Quantité de portion de fromages F |
Quantité de tranches de pain de mie P |
Quantité de tranches de saumon fumé T |
$\longrightarrow$ |
Quantité de sandwiches S |
|
1 |
||||
|
2 |
||||
|
3 |
||||
|
4 |
||||
|
5 |
||||
|
6 |
||||
|
7 |
||||
|
8 |
||||
|
9 |
||||
|
10 |
A2. Détermination du réactif limitant.
Une réaction chimique cesse lorsqu'au moins un des réactifs a totalement disparu.On parle de réactif limitant.
Comment le déterminer ?
|
Doc1 : Protocole expérimental.
|
|
|
|
Doc4 : La transformation chimique. L'hydrogénocarbonate de sodium solide réagit avec les ions oxonium contenues dans l'acide chlorhydrique selon l'équation : $NaHCO_{ \ 3,(s)} \ \ + \ \ H_3O^{ \ +} \ \ \longrightarrow \ \ CO_{2,(g)} \ \ + \ \ 2 \ h_2O_{ \ (l)} \ \ + \ \ Na^{ \ +}_{(aq)}$ Cette réaction montre que lorsqu'une mole de $NaHCO_{ \ 3,(s)}$ disparaît avec une mole de $H_3O^{ \ +}$ , alors il se forme une mole de $CO_{ \ 2(g)}$, deux moles de $H_2O_{ \ (l)}$ et une mole de $Na^{ \ +}_{(aq)}$ . |
|
Doc5 : Données : $M(H) \ = \ 1,0 \ g.mol^{ \ -1}$ $M(C) \ = \ 12,0 \ g.mol^{ \ -1}$ $M(O) \ = \ 16,0 \ g.mol^{ \ -1}$ $M(Na) \ = \ 23,0 \ g.mol^{ \ -1}$ $V_m \ = \ 24 \ L.mol^{ \ -1}$ |
A21. Réaliser.
Mettre en œuvre le protocole proposé pour les trois mélanges considérés.
A22. Observations.
Compléter le tableau suivant :
|
Mélange |
1 |
2 |
3 |
|
Couleur de la solution à l'état initial |
|||
|
Couleur de la solution à l'état final |
|||
|
Reste-t-il du solide à l'état final. |
|||
|
Volume de gaz dégagé. |
A23. Analyse.
$\bullet$ Quel semble être le réactif limitant dans chaque mélange ?
$\bullet$ Expliquer pourquoi le volume de gaz dégagé est le même dans les mélanges 2 et 3.
A24. Raisonner / Valider.
$\bullet$ Pour chaque mélange, déterminer la quantité de matière des réactifs et de $CO_{ \ 2}$ dégagé.
|
Mélange |
1 |
2 |
3 |
|
$n(HCO_3)$ |
|||
|
$n(H_3O^{ \ +})$ |
|||
|
$n(CO_2)$ |
$\bullet$ Justifier alors que le réactif limitant est bien celui déterminé pour chaque mélange.
A25. Conclure.
Que "limite" le réactif limitant ? Justifier.
A3. Synthèse d'une espèce odorante.
L'éthanoate de 3-méthylbutyle est utilisé comme agent de saveur. Cette substance est naturellement présente dans la banane. On peut la synthétiser au laboratoire en faisant réagir de l'acide éthanoïque avec de l'alcool isoamylique.
Comment déterminer la quantité produite de ce composé ?
|
Doc1 : Protocole expérimental. $\bullet$ Dans un ballon, introduire 10,0 mL d'alcool isoamylique et 10,0 mL d'acide éthanoïque. Ajouter quelques mL d'acide sulfurique concentré et quelques grains de pierre-ponce. $\bullet$ Equiper le ballon d'un réfrigérant à eau et mettre en route la circulation de l'eau. $\bullet$ Placer le ballon dans un chauffe-ballon posé sur un support élévateur. Porter le contenu à ébullition, sans bouillonnement excessif, pendant 30 minutes. $\bullet$ Retirer le chauffe-ballon et placer le ballon dans un bain d'eau froide. Verser lentement 30 mL d'eau froide dans le ballon. $\bullet$ Transvaser le contenu du ballon dans un erlenmeyer et le placer sous agitation magnétique pendant 5 minutes . $\bullet$ Récupérer le liquide huileux. |
|
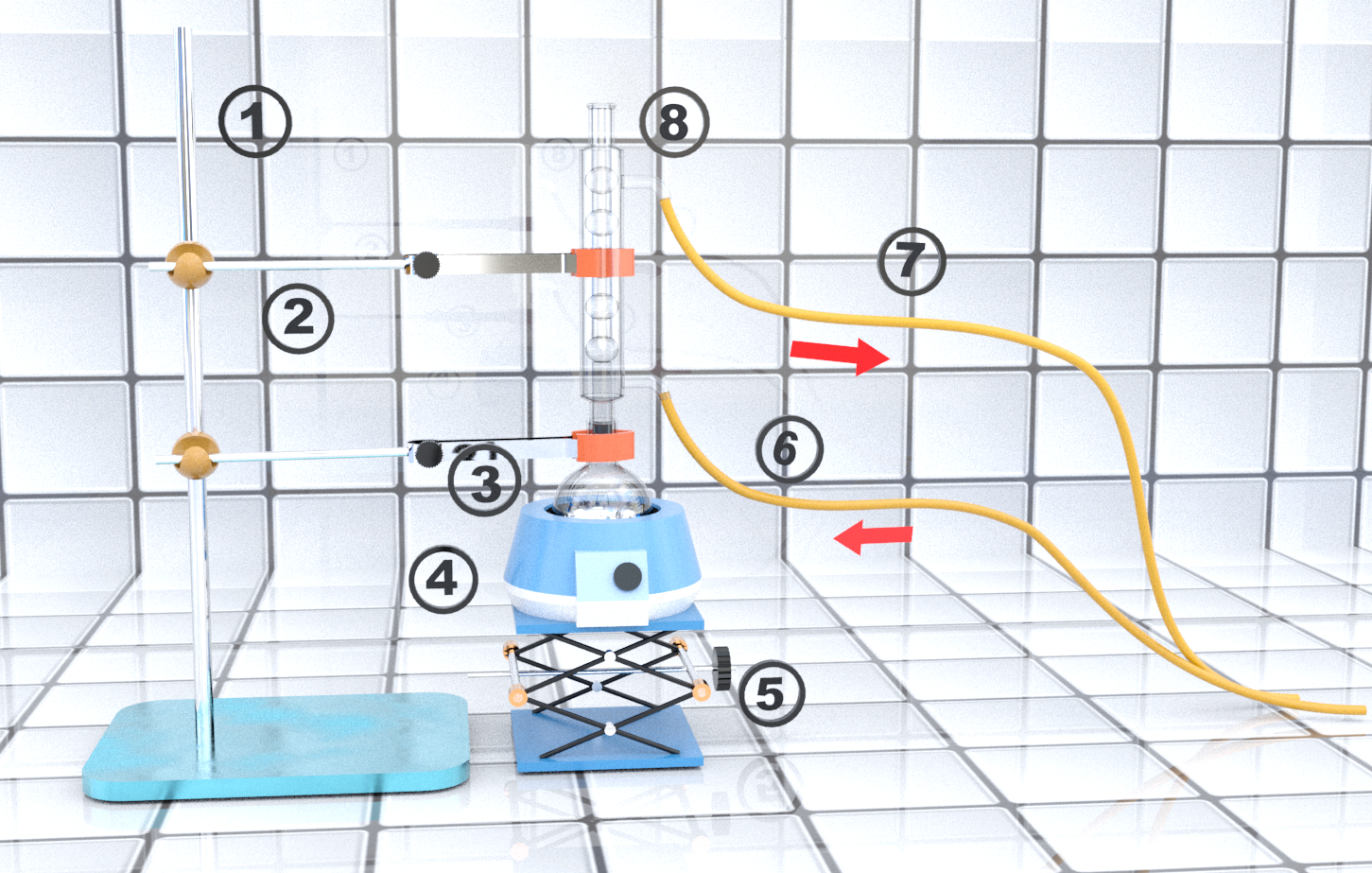
Doc2 : Montage.
|
|
Doc3 : Données. $\bullet$ La transformation réalisée a pour équation de réaction : $$ \begin{array}{c c c c c } C_5H_{12}O_{(l)} \ \ + & C_2H_{4}O_{2,(l)} \ \ & \overleftarrow{\longrightarrow} \ & C_7H_{14}O_{2,(l)} \ \ + & \ \ H_{2}O_{(l)} \\ Alcool & Acide & & éthanoate \ de & eau \\ isoamylique & éthanoïque & & 3-méthlybutyle & \\ \end{array} $$ $\bullet$ La synthèse ainsi réalisée a produit 9,2 mL d'éthanoate de 3-méthylbutyle. $\bullet$ Dans 100 kg de banane, on trouve en moyenne 1g d'éthanoate de 3-méthylbutyle.
|
$\bullet$ Associer les numéros affichés dans le doc2 au type de matériel.
|
① $\bullet$ |
$\bullet$ Réfrigérant à eau |
|
|
② $\bullet$ |
$\bullet$ Support élévateur |
|
|
③ $\bullet$ |
$\bullet$ Pinces |
|
|
④ $\bullet$ |
$\bullet$ Sortie d'eau |
|
|
⑤ $\bullet$ |
$\bullet$ Réfrigérent à eau |
|
|
⑥ $\bullet$ |
$\bullet$ Chauffe-ballon |
|
|
⑦ $\bullet$ |
$\bullet$ Entrée d'eau |
|
|
⑧ $\bullet$ |
$\bullet$ Potence |
$\bullet$ Déterminer les quantités de matière en acide éthanoïque et en alcool isoamylique introduites. En déduire le réactif limitant.
$\bullet$ Déterminer la quantité de matière de produit obtenu et la masse correspondante lors de la synthèse.
$\bullet$ Déterminer la quantité de matière d'éthanoate de 3-méthylbultyle contenue dans 100 kg de banane.
$\bullet$ En déduire la masse de banane qu'il faudrait utiliser pour produire la quantité de matière de produit obtenu lors de la synthèse. Conclure.
EXERCICES P93 à 99 :
13 ; 16 ; 17 ; 18 ; 20 ; 21 ; 23 ; 25 ; 27 ; 28 ; 33 ; 35 ; 39 ; 41 ; 43
COURS
C1. La transformation chimique.
C11. Définition.
$\bullet$ Au cours d'une transformation chimique, des espèces disparaissent et d'autres apparaissent.
$\bullet$ Chaque espèce chimique est représentée par une "formule" chimique.
$\bullet$ Cette représentation informe sur les constituants de l'espèce.
Exemples :
$\bullet$ Une molécule d'eau de formule chimique $H_2O$ est constituée de deuxatomes d'hydrogène (H) et d'un atome d'oxygène (O).
$\bullet$ Une molécule de propanone (acétone) de formule chimique $C_3H_6O$ est constituée de troisatomes de carbone (C), de sixatomes d'hydrogène (H) et d'un atome d'oxygène (O).
C12. Représentation.
$\bullet$ L'arrangement des atomes des molécules présentes initialement est modifié pour former d'autres molécules.
$\bullet$ Les molécules présentes initialement sont les "réactifs".
$\bullet$ Les molécules présentes initialement sont les "produits".
$\bullet$ Les molécules présentes initialement qui n'interviennent pas sont dites "spectatrices".
$\bullet$ Cette transformation est modélisée par une "réaction chimique".

Exemple :
Dans l'air, principalement constitué de dioxygène $\left ( O_2 \right )$ et de diazote $\left ( N_2 \right )$, le méthane $\left ( CH_4 \right )$ et le dioxygène $\left ( O_2 \right )$ peuvent réagir pour former du dioxyde de carbone $\left ( CO_2 \right )$ et de l'eau $\left ( H_2O \right )$.
|
$$ \begin{array}{c c c c c } \underbrace{ \color{blue}{CH_{4,(g)}} \ \ + \color{blue}{O_{2,(l)}} } \ \ & \ + \ 2 \ \underbrace{\color{green}{N_{2,(g)}}} \ & \longrightarrow \ & \underbrace{\color{red}CO_{2,(g)} \ \ + \ \ \color{red}{H_{2}O_{(l)}}} \ \ + & \ \ \underbrace{\color{green}{N_{2,(g)}}} \\ \color{blue}{Réactifs} & \ \ \ \ \ \color{green}{ Spectateur} & & \color{red}{Produits } & \color{green}{Spectateur} \\ \end{array} $$ |
||
|
1 atome de carbone $C$. 4 atomes d'hydrogène $H$. $2 \ \times \ 2 \ = \ 4$ atomes d'oxygène $O$. 2 atomes d'azote $N$. |
$\longrightarrow$ |
Finalement : 1 atome de carbone $C$. $2 \ \times \ 2 = 4$ atomes d'hydrogène $H$. $2 \ + 2 \times \ 1 \ = \ 4$ atomes d'oxygène $O$. 2 atomes d'azote $N$. |
C2. Les "coefficients stœchiométriques".
C21. Définition.
$\bullet$ Au niveau macroscopique, l'équation chimique indique sur les proportions (en mole) dans lesquelles les réactifs sont consommés et les produits apparaissent au cours de la réaction.
$\bullet$ Ils sont placés devant chaque espèce chimique présente.
|
$$ \begin{array}{c c c c c } \ \color{blue}{a} \ \ A \ \ + \ \color{red}{b} \ \ A \ \longrightarrow \ & \color{green}{c} \ \ C \ + \ \ \color{magenta}{d} \ \ D \\ \end{array} $$ |
||
|
a moles de l'espèce A b moles de l'espèce B |
$\longrightarrow$ |
c moles de l'espèce C d moles de l'espèce D |
Exemple :
Lors de la combustion du méthane $\left ( CH_4 \right )$ dans le dioxygène $\left ( O_2 \right ).
|
$$ \begin{array}{c c c c c } \ \color{blue}{1} \ \ CH_4 \ + \ \color{red}{2} \ \ O_2 \ \longrightarrow \ & \color{green}{1} \ \ CO_2 \ + \ \ \color{magenta}{2} \ \ H_20 \\ \end{array} $$ |
||
|
1 moles de l'espèce $CH_4$ 2 moles de l'espèce $O_2$ |
$\longrightarrow$ |
1 moles de l'espèce $CO_2$ 2 moles de l'espèce $H_2O$ |
NB : lorsque le coefficient stœchiométrique est égal à 1, il n'apparait pas dans la réaction.

Ainsi, dans la réaction précédente, on écrira :
$CH_4 \ + \ \color{red}{2} \ O_2 \ \ \longrightarrow \ \ CO_2 \ + \color{magenta}{2} \ H_2O$
C22. Conséquence.
|
$\bullet$ Lors de la transformation chimique tous les atomes présents initialement sont présents une fois la réaction chimique terminée : il y a conservation de la matère. $\bullet$ a présence de ces coefficients stœchiométriques qui implique que la masse totale des réactifs est égale à la masse des produits. |
 |
C23. Le réactif limitant.
Selon les quantités de matière présentes initialement (réactifs), une réaction peut être :
$\bullet$ Totale : toutes les quantités de matière des réactifs présents initialement sont consommées.
$\bullet$ Partielle : la quantité de matière d'au moins un des réactifs n'est pas entièrement consommée.
Exemple : Combustion du méthane dans le dioxygène.
$\bullet$ Réaction totale :
$$ \begin{array}{|c|c c c c c c|} \hline Réaction & CH_4 \ \ + & \color{red}{2} \ O_2 \ & \overrightarrow{ \ \ \ \ \ \ \ \ \ } & \ CO_2 \ + & \color{green}{2} \ H_2O \\ \hline Etat initial & \color{blue}{1} & \color{red}{2} \ & & \ \color{magenta}{0} \ & \color{green}{0} \ \\ \hline \end{array} $$
1 mole de $CH_4$ réagit avec 2 moles de $O_2$.
En introduisant les réactifs dans ces proportions, les deux réactifs seront entièrement consommés :
$$ \begin{array}{|c|c c c c c c|} \hline Réaction & CH_4 \ \ + & \color{red}{2} \ O_2 \ & \overrightarrow{ \ \ \ \ \ \ \ \ \ } & \ CO_2 \ + & \color{green}{2} \ H_2O \\ \hline Etat initial & \color{blue}{1} & \color{red}{2} \ & & \ \color{magenta}{0} \ & \color{green}{0} \ \\ \hline Etat final & \color{blue}{0} & \color{red}{0} \ & & \ \color{magenta}{1} \ & \color{green}{2} \ \\ \hline \end{array} $$
Les produits seront ainsi formés dans ces conditions stœchiométriques : 1 de $CO_2$ et 2 moles de $H_2O$.
$\bullet$ Réaction limitée :
$$ \begin{array}{|c|c c c c c c|} \hline Réaction & CH_4 \ \ + & \color{red}{2} \ O_2 \ & \overrightarrow{ \ \ \ \ \ \ \ \ \ } & \ CO_2 \ + & \color{green}{2} \ H_2O \\ \hline Etat initial & \color{blue}{2} & \color{red}{3} \ & & \ \color{magenta}{0} \ & \color{green}{0} \ \\ \hline \end{array} $$
1 mole de $CH_4$ réagit avec 2 moles de $O_2$.
En introduisant les réactifs dans ces proportions, il faudrait 4 moles de $O_2$ pour que la totalité de $CH_4$ disparaisse. Il n'y a donc pas suffisamment de $O_2$ pour que la réaction soit totale.
Le dioxygène est limitant.
$$ \begin{array}{|c|c c c c c c|} \hline Réaction & CH_4 \ \ + & \color{red}{2} \ O_2 \ & \overrightarrow{ \ \ \ \ \ \ \ \ \ } & \ CO_2 \ + & \color{green}{2} \ H_2O \\ \hline Etat initial & \color{blue}{1} & \color{red}{2} \ & & \ \color{magenta}{0} \ & \color{green}{0} \ \\ \hline Etat final & \color{blue}{0,5} & \color{red}{0} \ & & \ \color{magenta}{1,5} \ & \color{green}{2} \ \\ \hline \end{array} $$
Les produits seront ainsi formés dans ces conditions stœchiométriques : 1,5 mole de $CO_2$ et 3 moles de $H_2O$.
C3. Synthèse chimique.
Synthétiser une espèce chimique consiste à fabriquer une espèce chimique à partir d'autres espèces grâce à une transformation chimique.
La nature contient un très grand nombre d'espèces chimiques. On peut les extraire.
Certaines nous sont nécessaires et pour des raisons économiques ou écologiques, on doit les synthétiser au laboratoire.
Une synthèse doit être réalisée en respectant un protocole qui lui est propre.
Une synthèse peut être optimisée, par exemple en chauffant le milieu réactionnel.
Des normes de sécurité doivent être respectées du fait de la dangerosité possible de la réaction, ou de la nocivité des espèces chimiques.
Les espèces formées sont finalement identifiées par des mesures physiques (température de fusion, masse volumique…) ou par chromatographie sur couche mince.
Ajouter un commentaire