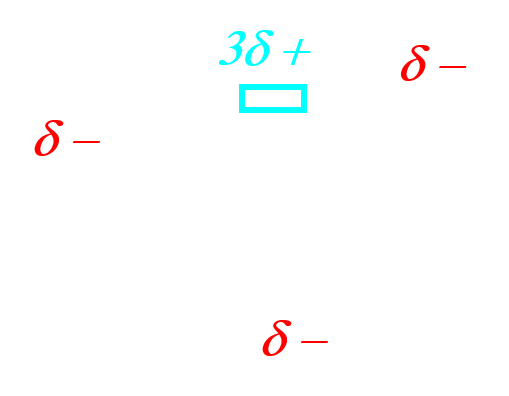Evolution temporelle d'un système chimique
ACTIVITES
A1 : Influence de la concentration, de la température et du solvant.
Problématique : Comment mettre en évidence l'influence des paramètres "concentration, température, solvant" sur la rapidité de la transformation ?
|
|
|
Doc 3 : Protocole.
|
• Ecrire la réaction d'oxydoréduction décrite dans le doc 1.
• Quelle est l'espèce responsable de l'opacification du milieu réactionnel ?
• En observant la réaction précédente, justifier la nécessité de l'acide chlorhydrique dans les produits.
• Compléter la ligne $\left [ S_2O^{2-}_{3(aq)} \right ]_{initiale} $ du tableau précédent.
• Mettre en œuvre le protocole du doc 3 et compléter la ligne Δt (s), correspondant au temps nécessaire à la disparition totale de la croix dessinée sur le papier.
• Conclure.
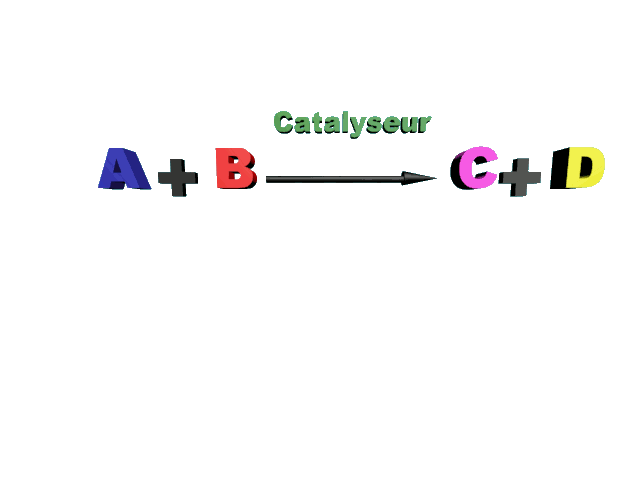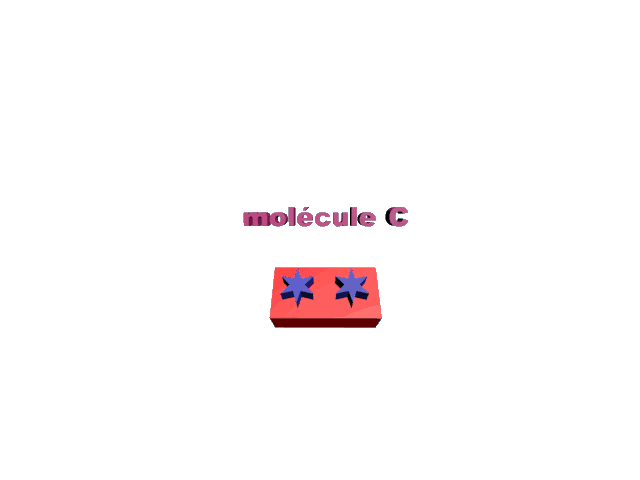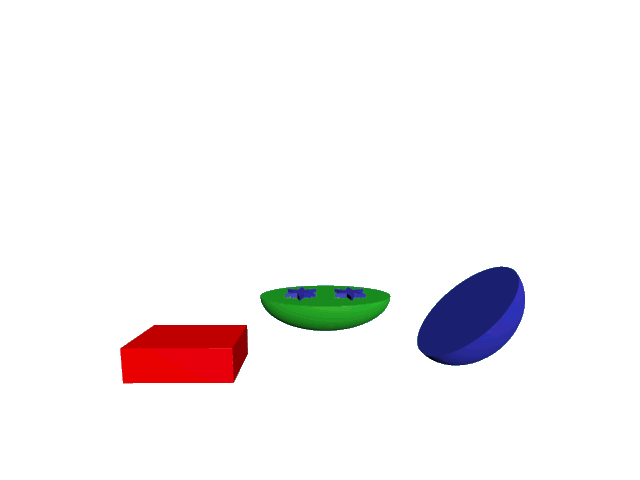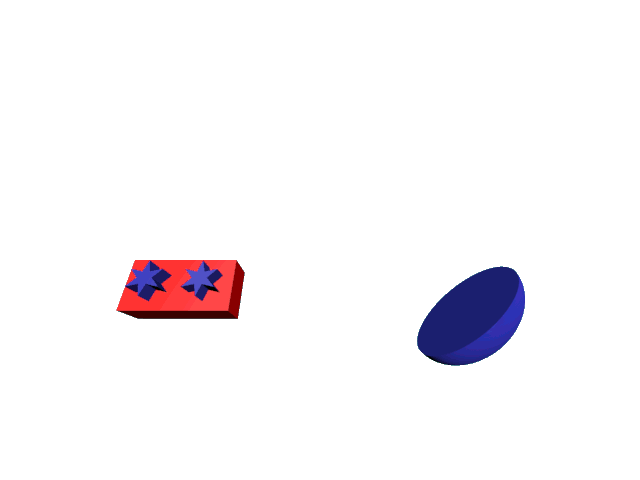
A2 : La catalyse.
Qu'est-ce qu'un catalyseur ?
Quels sont les différents types de catalyse ?
• Pourquoi le flacon comporte-t-il une date de péremption ?
• Quel est le rôle du tube 1 ? Qu'y observe-t-on ? Pourquoi ?
• Qualifier les différents produits ajoutés.
• Dans le tube 2, où se situe le dégagement gazeux ? Pourquoi ?
• Dans les tubes 3 et 4, où se situe le dégagement gazeux ? Pourquoi ?
A3 : Suivi spectrophotométrique et cinétique.
|
|
• Ecrire la réaction chimique support de cette étude.
• Pourquoi ne donne-t-on que la courbe de l'absorbance du diiode ? Conclure expérimentalement.
• Compléter la ligne ci du Doc 4, et écrire la relation de l'absorbance en fonction de la concentration en diiode $\left [ I_{2(aq)} \right] $.
• Compléter la dernière partie du programme Python fournie afin de faire apparaître l'évolution temporelle de la concentration en diiode, ainsi que sa variation temporelle. Tester.
|
from matplotlib import* from numpy import* from pylab import * ########Données expérimentales######### ####################################### ########Etalonnage######### Abeer=[] #######absorbance étalonnage###### Cbeer=[] #######concentration étalonnage###### kbeer=[] #######coefficient de proportionnalité étalonnage###### abs1=[] #######abscisses étalonnage###### ord1=[] #######ordonnées étalonnage###### t=[] #######temps###### A=[] #######absorbance###### C=[] #######Concentration en I2 pour l'évolution temporelle###### abs2=[] #######abscisses temps###### ord2=[] #######ordonnées C temps###### v=[0] #######ordonnées vitesse temps###### ########Beer-Lambert######### abs1=linspace(0,max(Cbeer),len(Cbeer)*100) ord1=linspace(0,max(Abeer),len(Abeer)*100) #######échelles coordonnées pour l'absorbance###### plt.plot(Cbeer,Abeer,color="blue",label="A=f(c)") #######tracé de l'absorbance mesurée###### for i in range(1,len(abs1)): k=ord1[i]/abs1[i] kbeer.append(k) coefbeer=sum(kbeer)/len(kbeer) #######calcul du coef###### print('Abeer= ',coefbeer,'x Cbeer') a='Abeer=%f'%round(coefbeer,2) #######écriture de la relation sur le graphique###### plt.plot(abs1,ord1,color="red",label=a+'xc') #######tracé de l'absorbance évaluée par Beer-Lambert###### plt.title("Etalonnage") #######affichage###### plt.legend(loc="upper right") plt.xlabel("Concentration") plt.ylabel("Absorbance") plt.grid() plt.show() ########Evolution temporelle de l'absorbance######### plt.plot(t,A,color="red",label='Aborbance mesurée') #######tracé de l'absorbance temporelle mesurée###### abs2=linspace(0,max(t),len(t)*100) #######échelles temps###### ord2=A[0]*exp(-log(2)*abs2/5) #######calculs des absorbances correspondantes###### plt.plot(abs2,ord2,color="blue",label="A=f(t)") #######tracé de l'absorbance temporelle calculée###### plt.title("Evolution temporelle de l'absorbance") #######affichage###### plt.legend(loc="upper right") plt.xlabel("temps") plt.ylabel("Absorbance") plt.grid() plt.show() ########Evolution temporelle de la concentration en I2######### #######Calcul de [I2] en utilisant Beer-Lambert###### #######tracé de[I2]=f(t)###### #######calcul de la vitesse######
#######tracé dev ([I2])=f(t)###### #######affichage###### |
A4 : Formalisme de la flèche courbe.
Modéliser les transferts électroniques lors d'une transformation chimique.
|
|
1a. Dans les réactions ? et ? localiser les sites donneurs et accepteurs de doublets d'électrons. Justifier en représentant les lacunes éléctroniques manquantes le cas échéant.
1b. Représenter par une flèche courbe les transferts de doublets d'électrons sur ces deux équations et identifier les nouvelles liaisons formées.
2a. Dans l'équation ?, justifier le sens de la flèche ? .
Donnée : χ(O) > χ(Cl) > χ(N) > χ(C) ≈ χ(H)
2b. Quel serait le produit issu de la seule flèche ??
2c. Pourquoi représente-t-on deux flèches courbes sur cette étape élémentaire ?
3a. Représenter la flèche courbe sur l'équation ?.
3b. Comment l'expliquer ?
4. Expliquer en une dizaine de lignes le formalisme des flèche courbe.
Exercices : 12 ; 13 ; 16 ; 17 ; 18 ; 19 ; 20 ; 21 ; (22) ; 24 ; 26 ; 28 ; 29 ; 31 ; 34 ; 38 P99 à 108.
COURS
C1 : Modélisation macroscopique.
C11. Transformations, facteurs cinétiques.
|
Une transformation chimique est dite lente si on peut suivre son évolution à l'œil nu ou à l'aide d'un appareil de mesure permettant de suivre l'évolution d'une grandeur chimique du milieu à l'aide d'un appareil de mesure courant (spectrophotomètre, pH-mètre, conductimètre…). Pour suivre l’évolution d'un système, on choisira un capteur qui permet de mesurer une grandeur reliée à la quantité de matière d'une des espèces chimiques du milieu. |
 |
|
Une transformation chimique est dite rapide, si sa durée ne dépasse pas la durée de la persistance rétinienne soit 1/100ème de seconde. transformation rapide entre les ions iodure et les ions plomb. |
 |
C12. Catalyse, catalyseur.
Un catalyseur est une espèce chimique, différente des réactifs, dont la présence diminue la durée de réaction.
Le catalyseur interagit toujours avec les réactifs, mais il est intégralement restitué en fin de réaction : il n'apparaît donc pas dans l'équation bilan et il est réutilisé sans s'altérer.
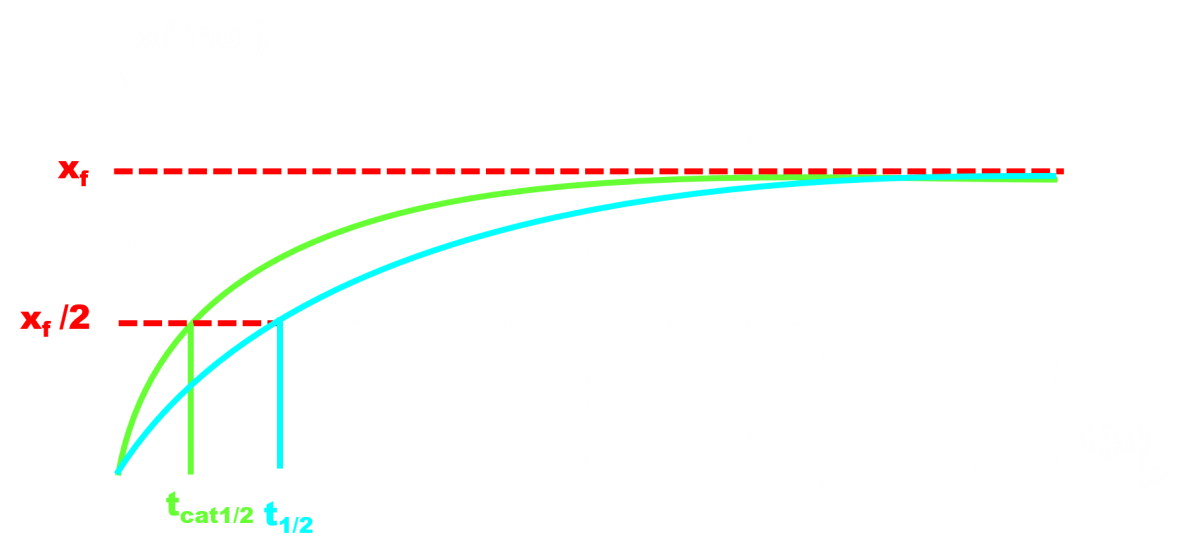
Evolution temporelle d'un même système chimique :
Sans catalyseur (bleu)
Avec catalyseur (vert)
C13. Transformations, facteurs cinétiques.
Catalyse homogène :
Le catalyseur et les réactifs forment un mélange homogène.
Ils sont dans le même état dans le milieu réactionnel.
Catalyse hétérogène :
Le catalyseur et les réactifs forment un mélange hétérogène.
Ils ne sont pas dans le même état.
|
Catalyse enzymatique: Le réactif appelé substrat se fixe sur l'enzyme pour y être transformé. Le catalyseur est une enzyme qui se retrouve intacte en fin de réaction. Sa structure spatiale facilite la rencontre des réactifs. |
 |
C2. Suivi temporel
C21. Vitesse volumique.
On étudiera des transformations qui se passent dans un milieu de volume constant.
- La vitesse volumique d'apparition d'un produit est définie par :
|
[Produit] : concentration du produit en mol/L. t : temps en secondes. v : vitesse en mol.L-1.s-1 |
- La vitesse volumique de disparition d'un réactif est définie par :
|
[Réactif] : concentration du réactif en mol/L. t : temps en secondes. v : vitesse en mol.L-1.s-1 |
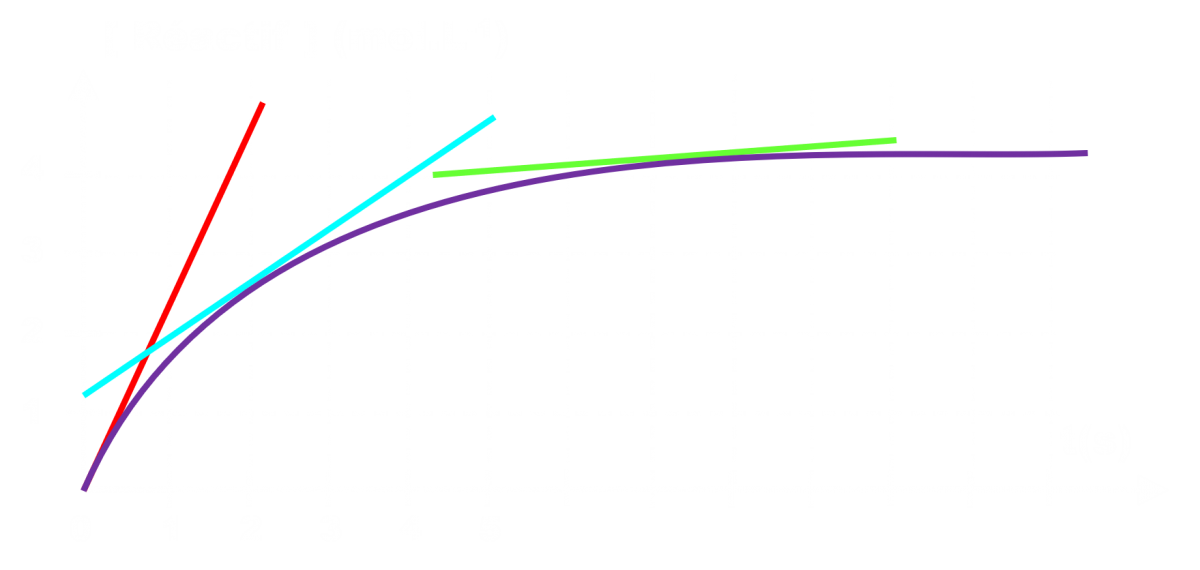
Le coefficient directeur de la tangente (vitesse) diminue avec le temps.
La quantité de matière du réactif diminue avec le temps.
C22. Temps de demi-réaction.
Le temps de demi-réaction t1/2 est le temps au bout duquel l'avancement vaut la moitié de l'avancement final.
Il permet d'évaluer la durée caractéristique de la réaction.
C23. Loi de vitesse d'ordre 1.
Une réaction lente est dite d'ordre 1 par rapport à un réactif A si la vitesse de disparition (ou d'apparition pour un produit) est proportionnelle à sa concentration.
C3. Modélisation microscopique.
C31. Mécanisme réactionnel.
A l'échelle moléculaire, une réaction chimique peut être décomposée en étapes élémentaires. L'ensemble de ces étapes constitue le mécanisme réactionnel. Exemple : transformation d'un alcool en alcène catalysée par l'ion H+.
| Etape 1 : | 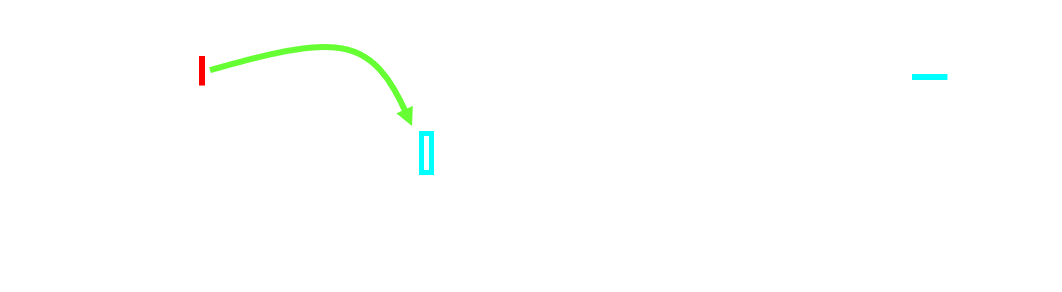 |
| Etape 2 : | 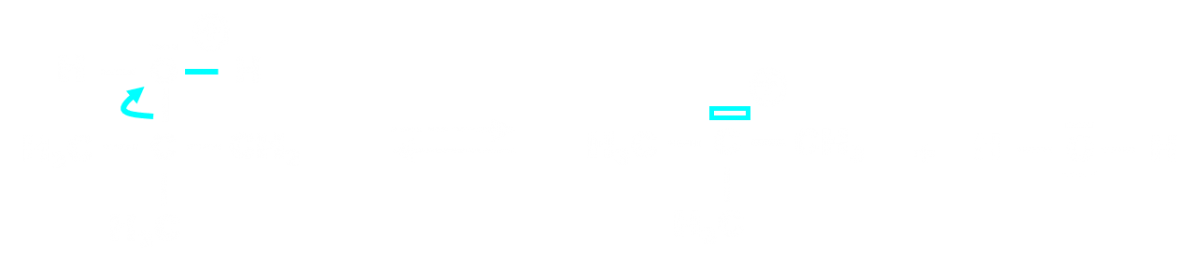 |
| Etape 3 : | 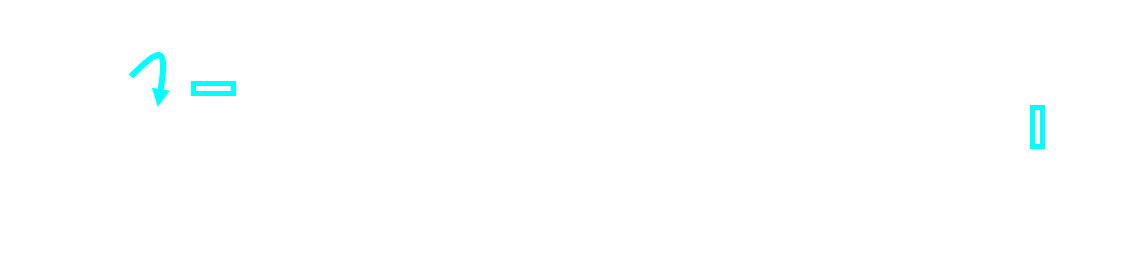 |
C32. Formalisme de la flèche courbe.
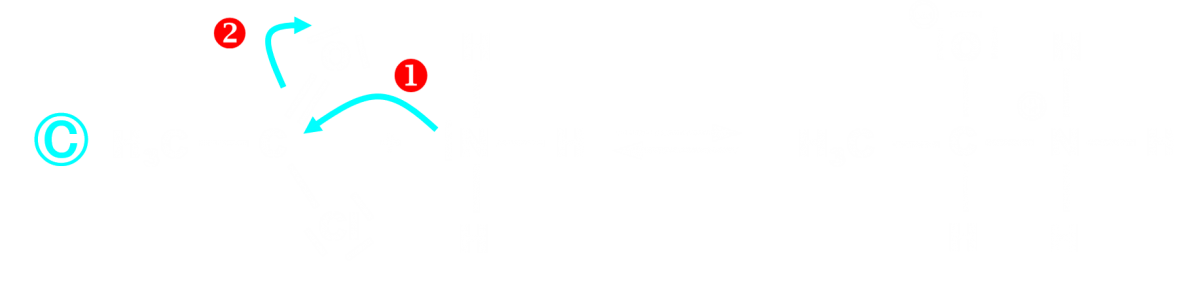
- Lors des étapes élémentaires, la formation et/ou la rupture d'une liaison s'explique par le déplacement d'un ou de plusieurs doublets électrons. Ce déplacement est modélisé par une flèche courbe.
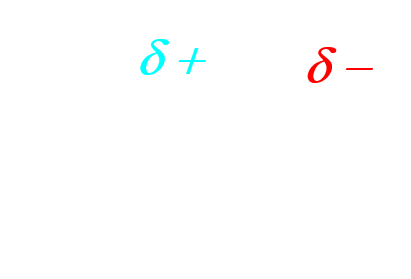
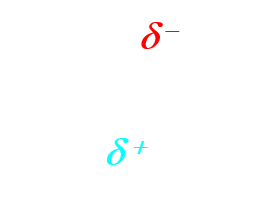
- Un site donneur de doublet d'électrons est un site de forte densité électronique.
- Un site accepteur de doublet d'électrons est un site à faible densité d'électrons.
- Le déplacement de doublets lors d'une étape est modélisé par une flèche courbe qui part d'un site donneur et pointe vers un site accepteur.
Exemples :
| Sites donneurs : |
|
|||
| Sites accepteurs : |
|
C33. Interprétation microscopique des facteurs cinétiques.
• Un choc entre deux entités réactives est efficace s'il entraîne une modification des liaisons chimiques de ces deux entités.
• Lorsque la température augmente, l'agitation thermique augmente et ainsi, les chocs entre molécules deviennent plus violents. Ils sont donc plus efficaces.
• De même, lorsque la concentration des réactifs est plus élevée, il y a plus d'entités par unité de volume. Les chocs deviennent plus probables et donc plus efficaces.
Ajouter un commentaire