Spectre RMN du proton
ACTIVITES
A1 Spectroscopie RMN du proton dans le propan-1-ol
A11 Principe de la spectroscopie RMN
|
La résonance magnétique nucléaire (RMN) est une technique qui permet d'identifier les atomes d'hydrogène d'une molécule ainsi que la nature et le nombre d'atomes de leur environnement proche. L'appareil émet une OEM qui interagit avec le noyau des atomes d'hydrogène, donc avec le nombre de proton, d'où le nom de RMN du proton. On place un échantillon de matière dans un champ magnétique
Un spectre RMN est constitué d'un ensemble de signaux, constitués d'un ou plusieurs pics fins. Chaque signal correspond à un atome ou groupe d'atomes d'hydrogène. L'environnement de l'atome ou du groupe d'atomes influe sur :
|
A11a Visionnage de la vidéo.
https://www.youtube.com/watch?v=swvc0fQL5RQ
- Pourquoi ne faut-il pas approcher d'objets métalliques de l'appareil de mesure ?
- Dans l'abréviation RMN, que signifie le M ? le N ?
- Comment les atomes d'hydrogène sont-ils excités ?
A11a Visionnage de spectre.
- Ouvrir le logiciel Specamp.
- Cliquer sur spectroscopie RMN.
- Charger le spectre HNMR_1-propanol.jdx.
- Pour agrandir une partie du spectre, cliquer avec le bouton gauche de la souris puis déplacer le curseur.
- Pour annuler le zoom, cliquer sur le bouton droit de la souris.
4. Quelles sont les grandeurs physiques et leurs unités apparaissant sur les axes du spectre RMN ?
5. Ecrire les formules semi-développée et développée du propan-1-ol.
6. Compléter le tableau ci-dessous, correspondant aux déplacements chimiques croissants.
| Nombre de pics | déplacement chimique δ (ppm) | hauteur des sauts ou palier | |
| signal 1 | |||
| signal 2 | |||
| signal 3 | |||
| signal 4 |
A11c Attribution des protons (ou groupes de protons) à chaque signal.
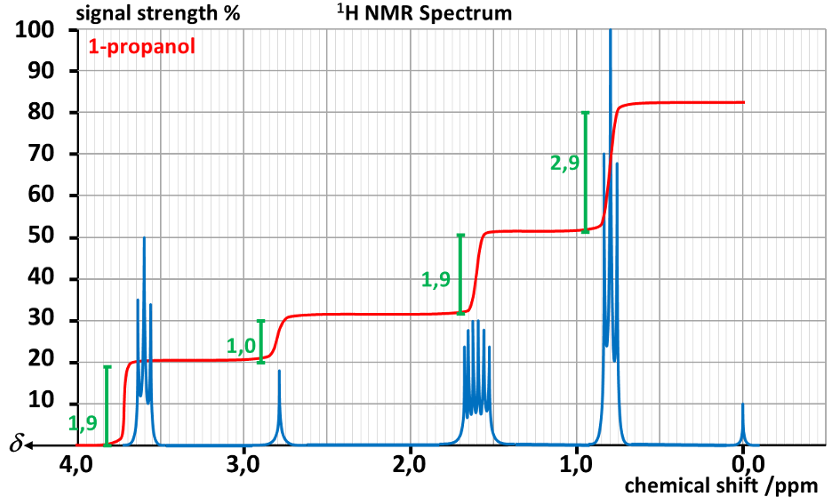
7. A l'aide du tableau donné en annexe, attribuer à chaque signal le groupe de protons correspondant.
A11d Protons équivalents/multiplicité du signal.
|
Dans le cas des molécules simples, mes protons sont dits "équivalents" dans les cas suivants :
Dans ces cas, chaque groupe de protons équivalents donne un seul signal.
Dans une molécule, les protons liés à un atome de carbone interagissent avec les protons portés par les atomes de carbone voisins : il y a couplage entre les atomes |
8. Expliquer pourquoi le spectre visionné comporte 4 signaux.
9. Expliquer la multiplicité de chaque signal.
A11e Hauteur des paliers.
|
Souvent, sur le spectre une courbe d'intégration apparaît. Elle est constituée de paliers successifs dont la hauteur de chacun est proportionnelle au nombre de protons qui résonnent. |
10. Expliquer la hauteur de chaque palier.
A12 Exercices sur Specamp
NB : Ne pas effectuer d'exercice où la molécule contient des cycles benzéniques.
Pour consulter les nombres d'onde correspondant aux liaisons cliquer sur spectre IR du menu, puis étude par fonction.
Pour résoudre d'autres exercices, cliquer sur spectre IR puis attribution spectre formule.
A12a Spectre IR.
- Cliquer sur l'option spectre IR.
- Organigramme de détermination.
- Effectuer les exercices proposés.
A12b Spectre RMN.
· Attribution un spectre à une formule.
- Cliquer sur spectre RMN
- Attribution spectre formule
- Effectuer les exercices proposés.
Attribution des protons aux signaux.
- Cliquer sur spectre RMN
- Attribution protons signaux
- Après chaque molécule, cliquer sur quitter module puis
- Cliquer sur spectre RMN
- Attribution signaux
A2 Etude d'un spectre RMN.
A21 Vocabulaire.
Compléter le texte ci-dessous :
· Un spectre RMN est constitué d'un ensemble de ……………………….., eux-mêmes formés de ……………
· L'axe des abscisses est orienté vers la ………………….. et représente le ……………………………………. noté d d'unité ……………………. (parties par million).
· Le signal de ………………………. à δ = 0 ppm correspond aux protons du TMS (tétraméthylsilane).
A22 Prévision du nombre de signaux.
• Les protons possédant le même ……………………….. sont dits équivalents.
• Chaque groupe de protons équivalents donnent un ………………….. de même ……………………………
Application : Pour chaque molécule ci-dessous, indiquer le nombre de signaux présents dans son spectre RMN (on pourra repérer les protons équivalents avec des couleurs différentes)
| Molécule | Nom | Nombre de signaux |
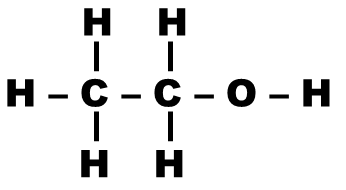 |
||
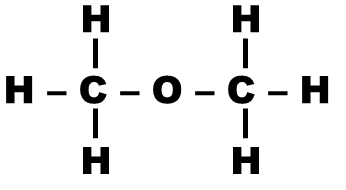 |
||
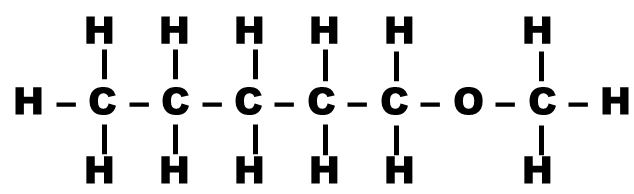 |
A23 Utilisation de la courbe d'intégration.
· Les spectres RMN sont souvent accompagnés d'une ……………………………………………..
· La hauteur hi de chaque palier est proportionnelle au nombre de ……………………… ayant le même environnement chimique.
 |
Compléter : h1 = ………………. h2 = ………………. h3 = ………………. h1/ h2 = ………………. h1/ h3 = ……………….
Associer les protons équivalents à chaque signal :……………………......... …………………………… …………………………… …………………………… …………………………… ……………………………. |
A24 Utilisation de la multiplicité d'un signal (règle des n+1 uplets)
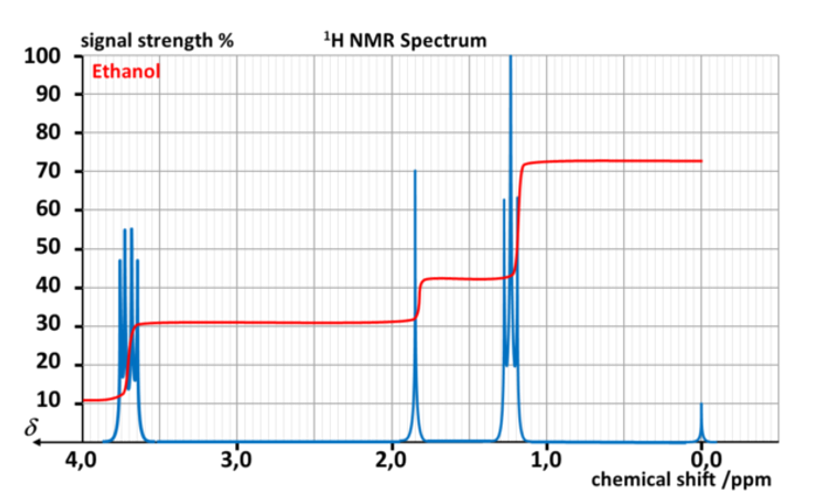
· Un spectre RMN est composé de différents massifs (…………………………..) qui peuvent être formés d'un seul pic (…………………………..), de deux pics rapprochés (………………………….) de trois pics rapprochés (…………………………..), de quatre pics rapprochés (…………………………..) etc.
· Cette multiplicité informe sur le nombre de protons portés par l'atome de carbone ……………………….
Expliquer alors la multiplicité de chaque pic pour l'éthanol.
A3 Démarche d'investigation.

Dans le laboratoire où travaille Paul, les produits chimiques sont rangés par famille.
Dans une rangée, il est indiqué "alcools C4H10O".
Cependant, les flacons sont dépourvus d'étiquette.
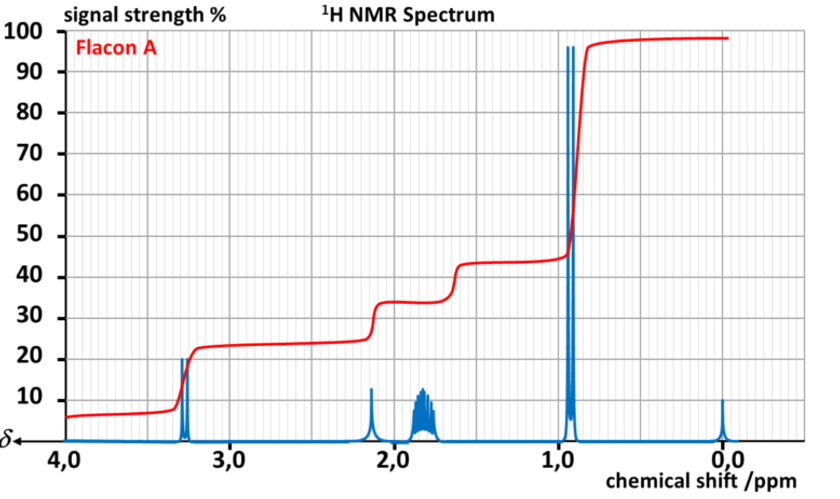
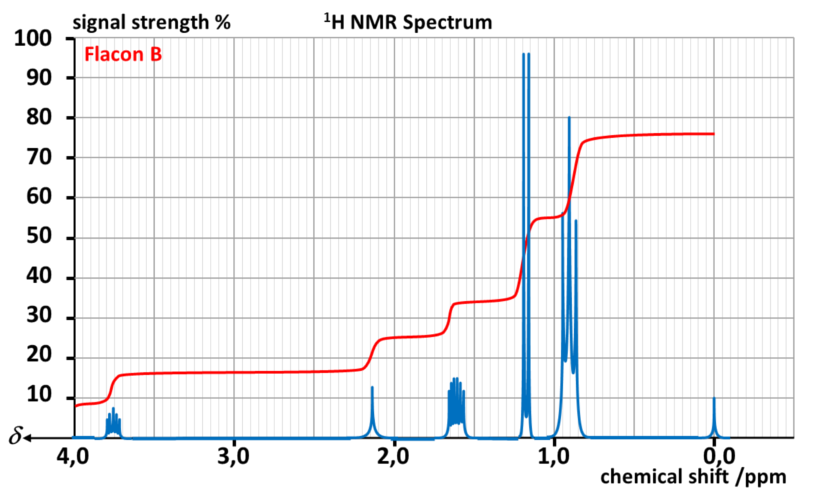
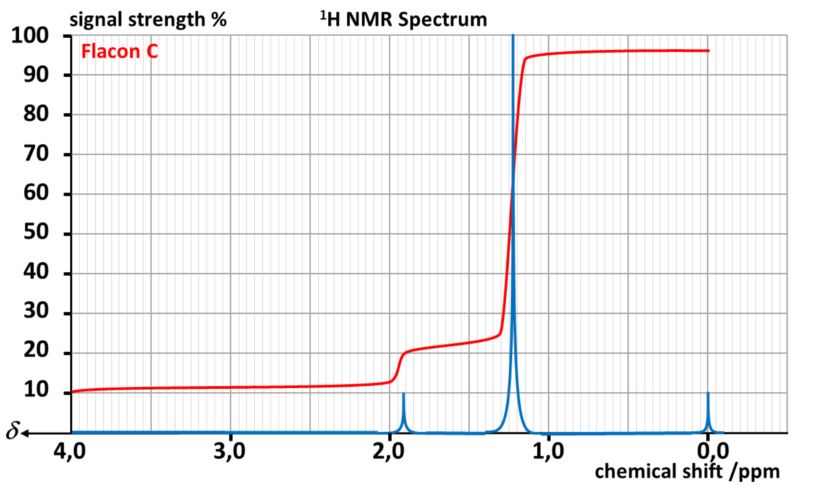
Il réalise alors un spectre RMN par flacon.
Données :
| Type de proton | δ en ppm |
| M- OH et M - OR | 3,2 - 3,6 |
| M - C - OH et M - C - OR | 1,2 - 1,6 |
 |
 |
 |
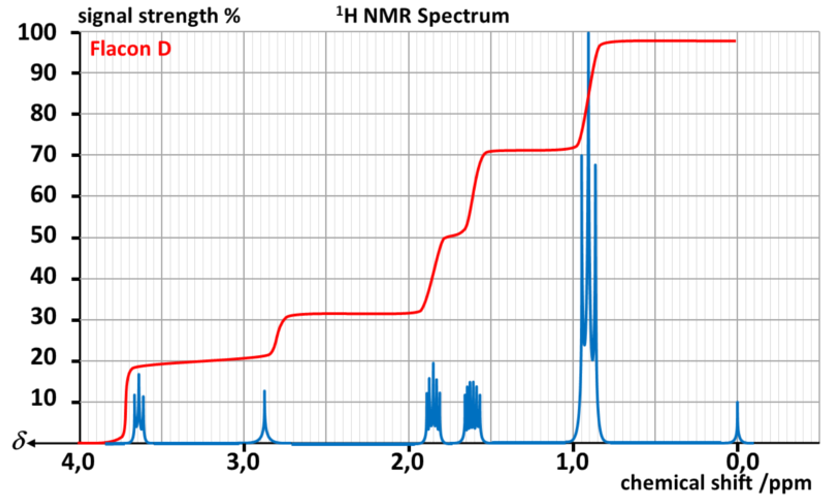 |
A31. Indiquer les noms, formules topologiques et développées des alcools de formule C4H10O
A32. Associer chaque flacon à l'alcool correspondant.
A33. Chercher les températures d'ébullition et de fusion de chaque isomère.
COURS
C1 Présentation d'un spectre RMN
C11 Origine du spectre
Résonance Magnétique Nucléaire :
- Le noyau d'un atome d'une molécule placée dans un champ magnétique peut absorber un quantum d'énergie lorsqu'il est soumis à certaines ondes électromagnétiques.
- A cette énergie correspond une fréquence (E = hν) appelée fréquence de résonance.
- Dans le cas de la RMN du proton, on se limite à l'atome d'hydrogène 11 H(proton).
- Les protons d'une molécule insérée dans ce champ magnétique vont résonner à différentes fréquences, selon leur environnement.
C12 Exemple de spectre RMN
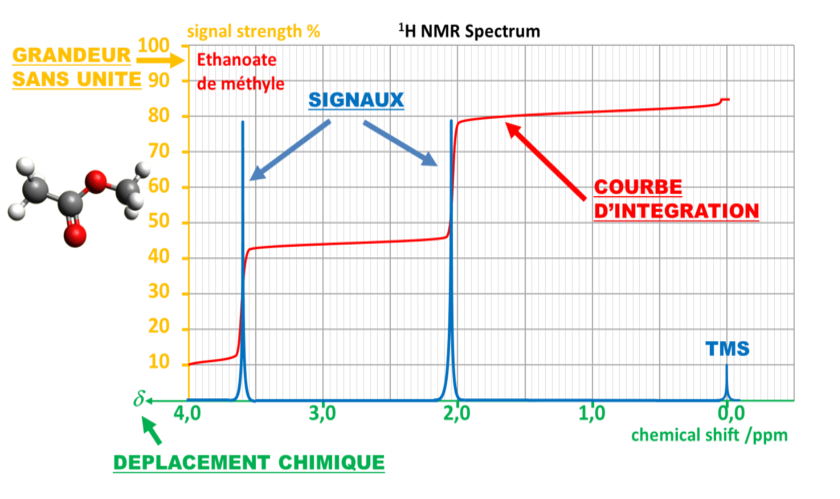
C2 Interprétation d'un spectre RMN
C21 Déplacement chimique :
La fréquence de résonnance ν d'un proton dépend de son environnement :
- Si la densité électronique autour du proton est importante, l'influence du champ magnétique imposé sera faible. On dit que le proton est blindé. Conséquence : la fréquence de résonance est faible.
- Si la densité électronique autour du proton est faible, l'importance du champ magnétique imposé sera importante. On dit que le proton est déblindé. Conséquence : la fréquence de résonance est importante.
NB : c'est dans le cas où le proton est proche d'atomes à forte électronégativité.
Par définition, le déplacement chimique est : 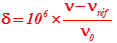 il s'exprime en ppm (partie par million)
il s'exprime en ppm (partie par million)
| ν : fréquence de résonance du proton | 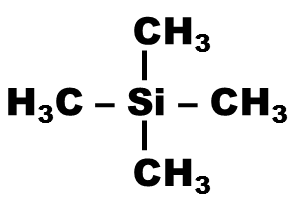 |
| νréf : fréquence de résonance du proton dans le TétraMéthylSilane | |
| ν0 : fréquence imposée par le champ magnétique |
Dans le TMS, les 12 protons sont très blindés, et l'action du champ magnétique est négligeable.
Pour ces protons, le déplacement chimique est donc nul.
Conséquences :
- Plus le proton est blindé (moins il vibre), plus la fréquence de résonance est faible et par conséquent le déplacement chimique.
- Plus le proton est déblindé (plus il vibre), plus la fréquence de résonance est importante et par conséquent le déplacement chimique.
Exemple :
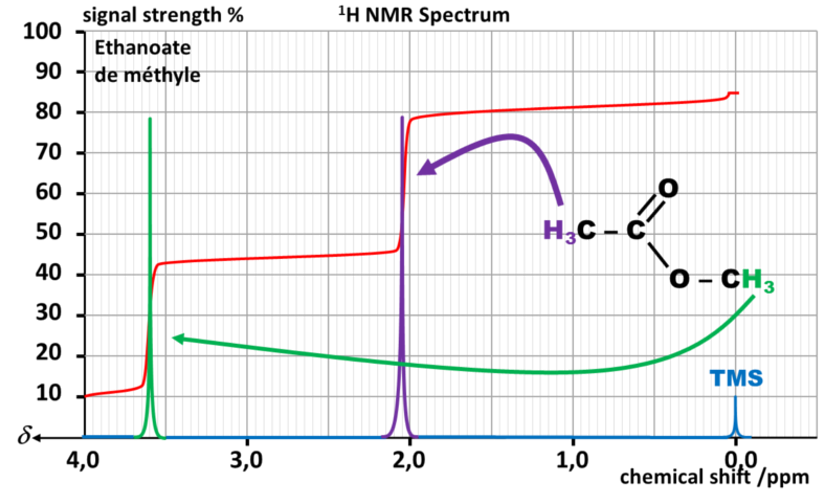
Sur le spectre de l'éthanoate de méthyle, les protons en vert sont proches de l'atome d'oxygène très électronégatif, le déplacement chimique induit par le champ magnétique sera plus important que pour les protons en violet.
Dans ce cas, on peut donc attribuer chaque pic de résonance à un type de proton.
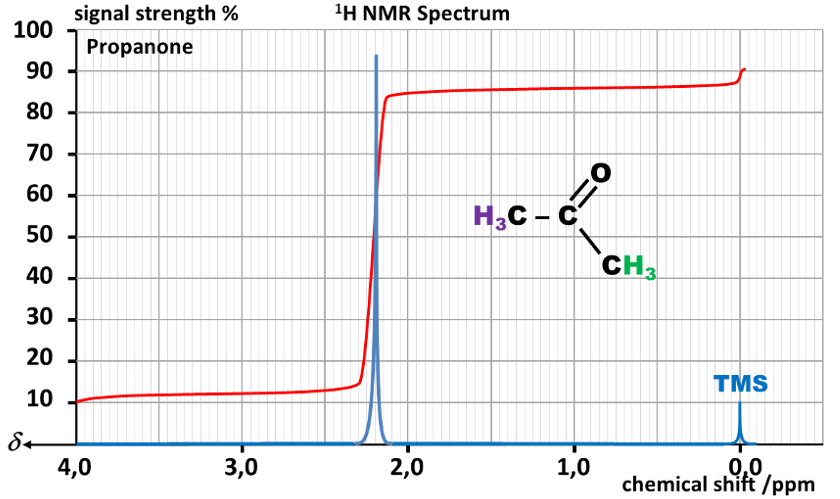
C22 Protons équivalents :
Dans une molécule, des atomes d'hydrogène sont équivalents s'ils ont le même environnement chimique.
Ils sont représentés par le même signal sur le spectre. Par conséquent, le nombre de signaux dans le spectre RMN est égal au nombre de groupes de protons équivalents dans la molécule.
|
Règle : En première approximation, on pourra considérer que des atomes d'hydrogène sont équivalents si :
|
Exemple :
C23 Intégration du signal :
|
La courbe d'intégration du spectre est constituée de paliers
|
Exemple :
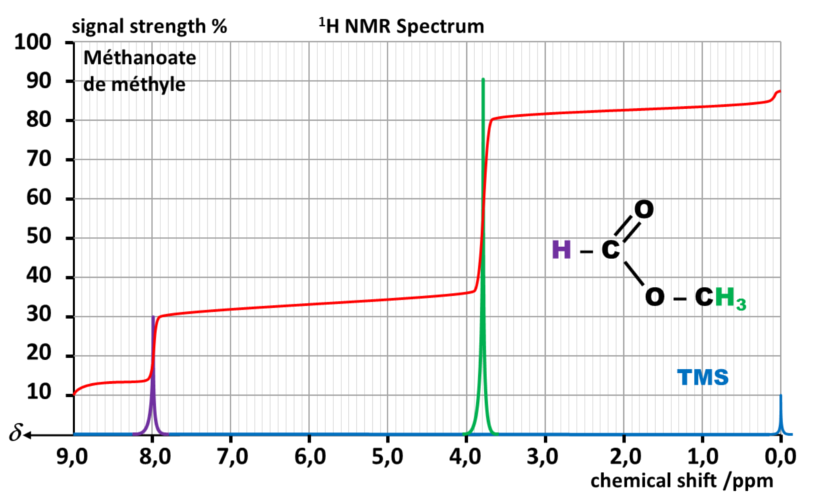
Le signal vert est dû à trois fois plus de protons que le signal violet.
La hauteur du palier correspondant au signal vert est donc trois fois plus grande que celle du signal violet.
C24 Multiplicité des signaux :
Le signal de résonance peut comporter plusieurs pics.
Ce signal est alors appelé multiplet.
Cette démultiplication des signaux est due aux interactions entre protons voisins non équivalents.
|
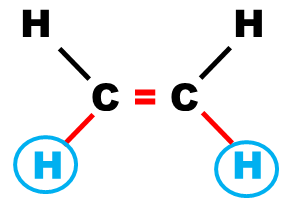
Définition : Deux protons sont dits "voisins" s'ils sont séparés par trois liaisons, simples ou multiples |
Exemple :
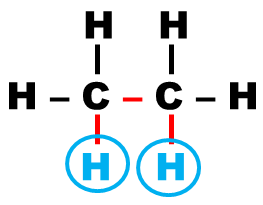 |
 |
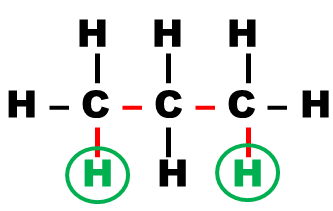 |
| Protons voisins | Protons voisins | Protons non voisins |
|
Règle des (n+1)-uplets : Un groupe de protons(a) équivalents ayant pour voisins n (b) protons non équivalents à (a) présente un signal de résonance sous forme d'un multiplet de (n+1) pics. |
Exemple : Molécule de 1-bromobutane.
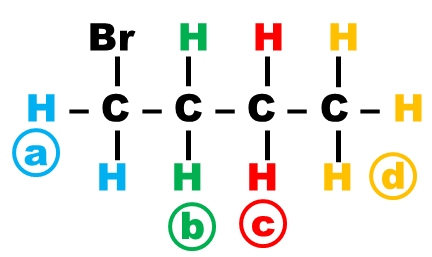
| Groupes de protons | Nombre de protons | Protons voisins | Nombre de pics | Hauteur du signal |
| (a) | ||||
| (b) | ||||
| (c) | ||||
| (d) |
C25 Analyse d'un spectre de RMN :
· Compter le nombre de signaux pour déterminer le nombre de groupes de protons équivalents.
· Utiliser la courbe d'intégration pour déterminer la proportion de protons associés à chaque signal.
·Analyser la multiplicité d'un signal pour dénombrer les protons équivalents des protons responsables d'un signal.
· Utiliser une table de déplacement chimique pour vérifier la formule obtenue à l'issue des étapes précédentes pour identifier la formule de la molécule s'il reste des ambiguïtés.
NB : le couplage entre protons équivalents n'est jamais observé
Ajouter un commentaire

