Sprectres UV-visible et IR
ACTIVITES
A1 Utiliser un spectrophotomètre UV-visible
Les confiseurs utilisent des colorants alimentaires afin que le produit associé reflète la couleur de la matière première, ou celle associée au produit.
L'UE fixe pour tous les colorants alimentaires, des valeurs de dose journalière admissible (DJA).
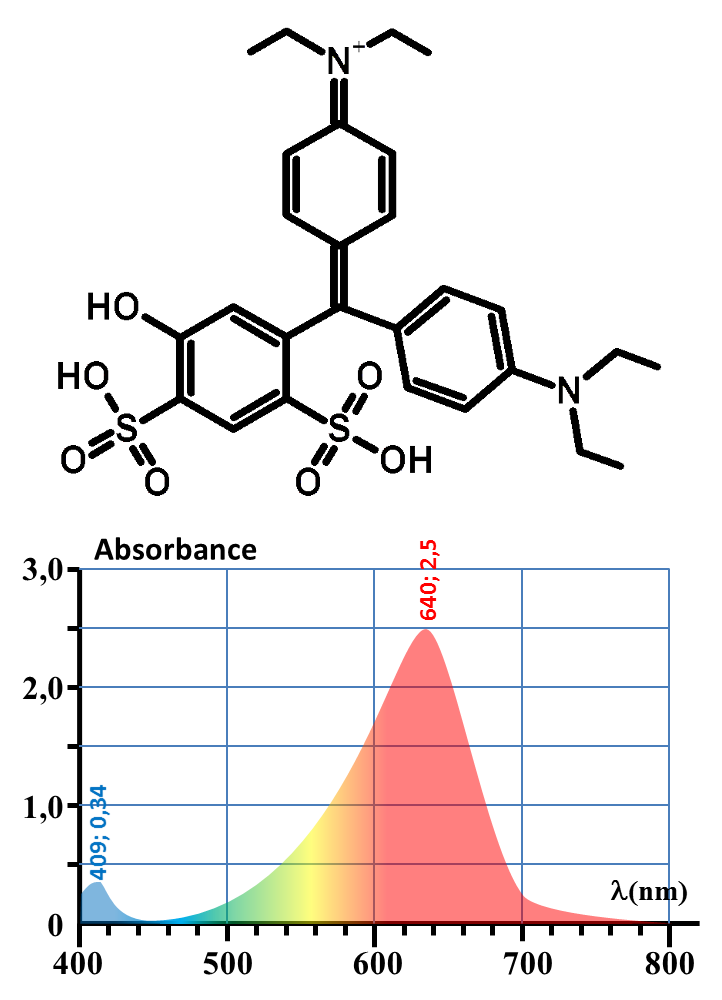
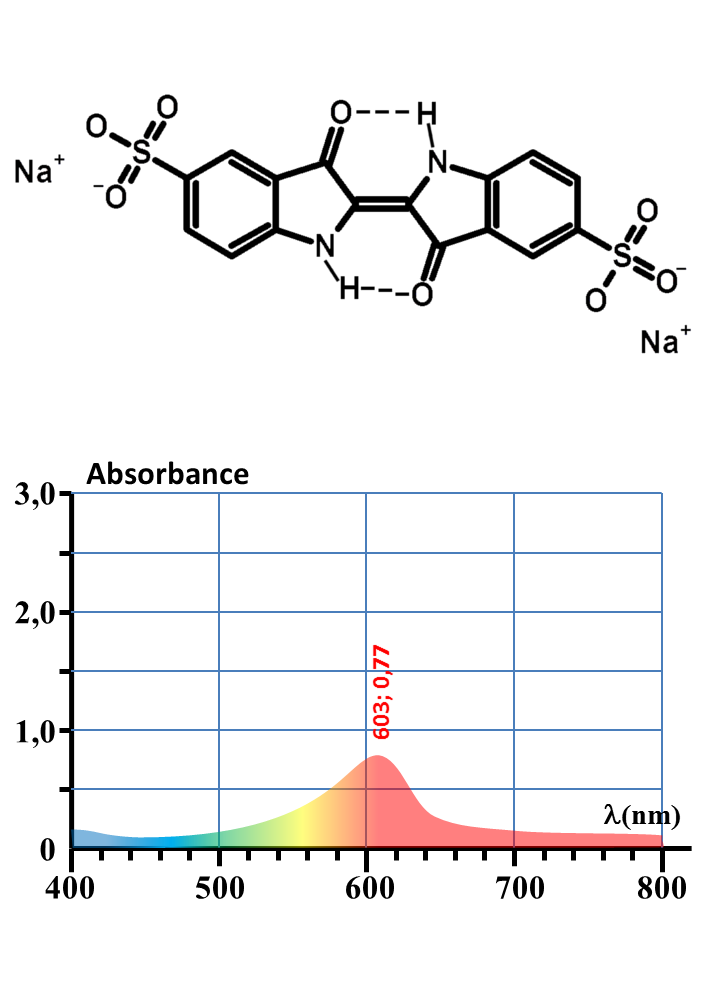
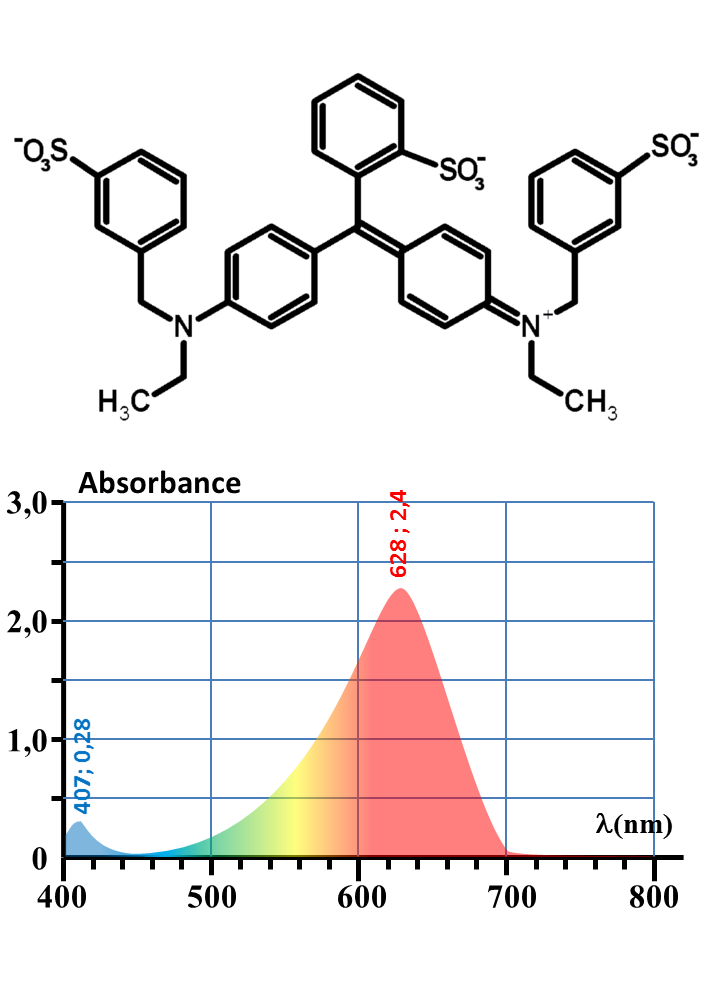
| Colorant |
E131 (bleu patenté) |
E132 (Indigotine) |
E133 (bleu brillant) |
| DJA (mg/kg/j) | 2,5 | 5,0 | 10,0 |
| M(g/mol) | 560 | 420 | 747 |
Quels est le colorant bleu présent dans un bonbon Schtroumpf ?
Quelle masse de ce colorant est présente dans un bonbon ?
|
Matériel à disposition :
Solutions bleues d'un des trois colorants |

|
E131
|
E132
|
E133
|
1. Expliquer une raison probable de la nature colorée de ces trois substances.
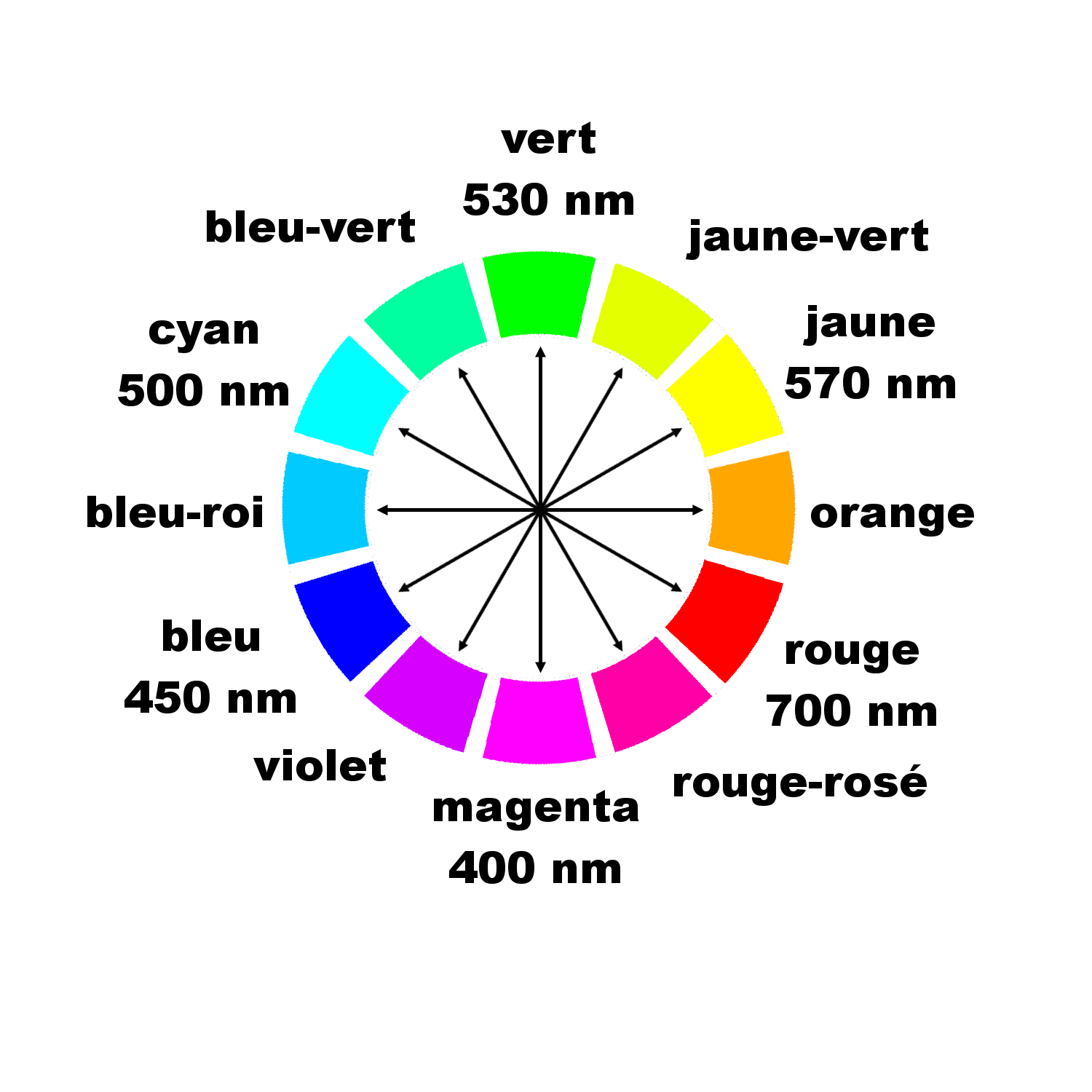
2. Expliquer leur couleur apparente.
3. Proposer un protocole permettant de répondre aux deux questions à la fois.
4. Mettre en œuvre.
5. Conclure pour une personne de 60 kg.
A2 Etude de spectres infrarouges.
Comment utiliser un spectre infrarouge pour identifier les liaisons particulières présentes dans une molécule ?
|
Document 1
|
||||||
NB : Les spectres ci-dessus sont les spectres d'absorption en phase gazeuse.
A21. Observer.
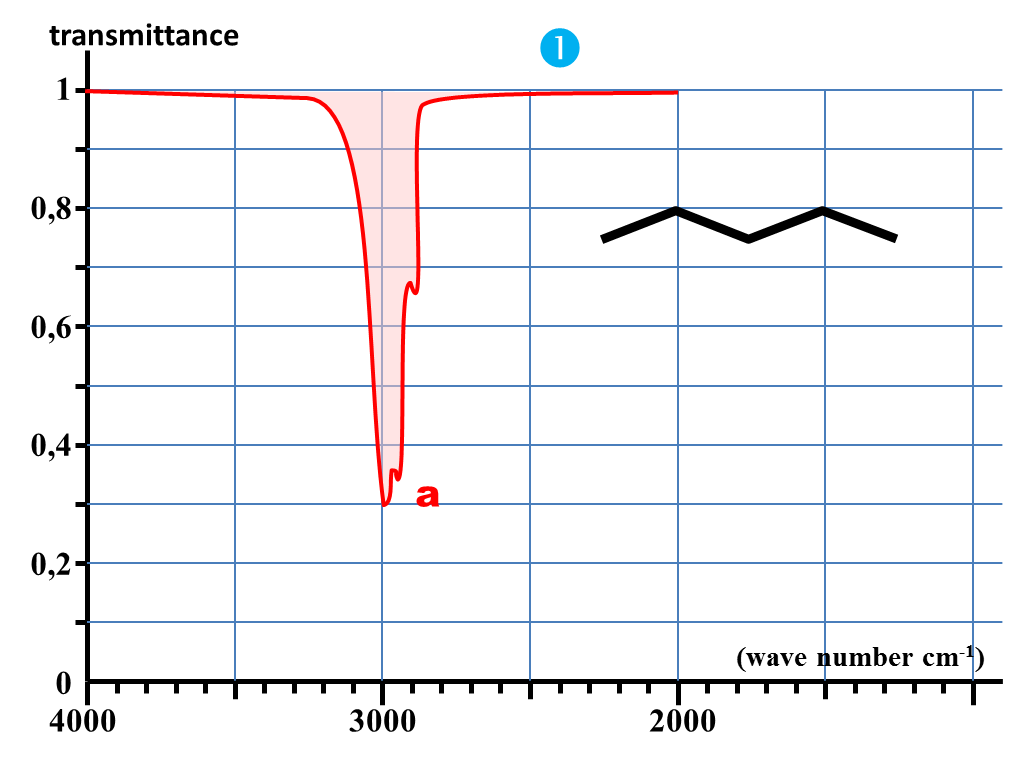
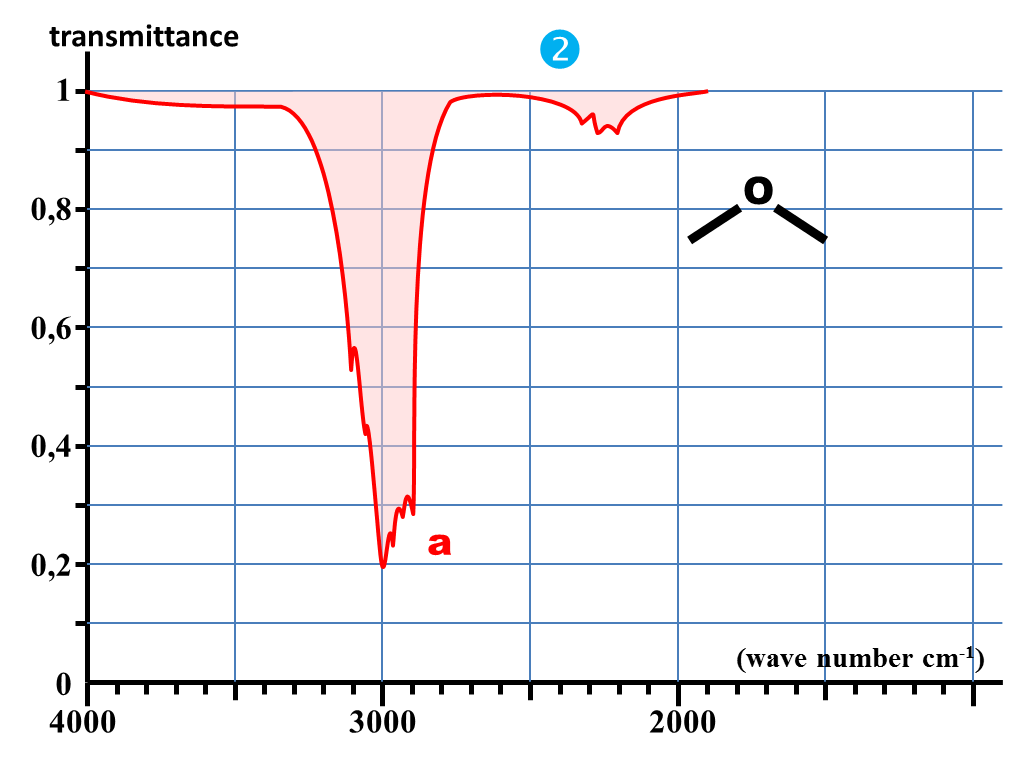
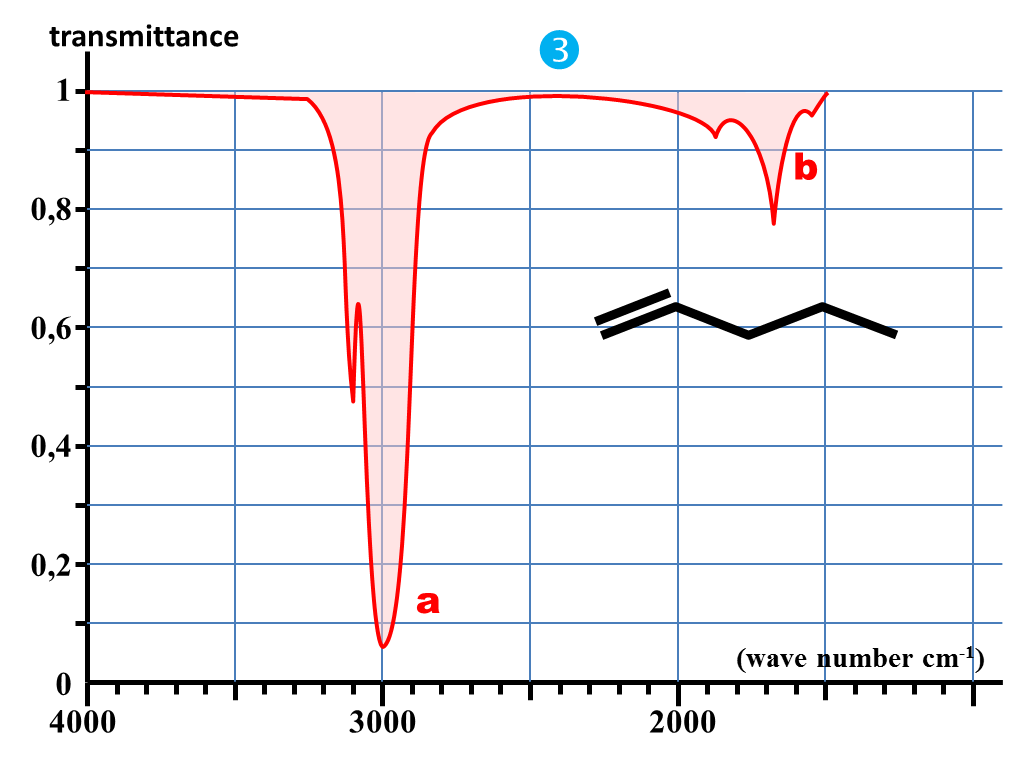
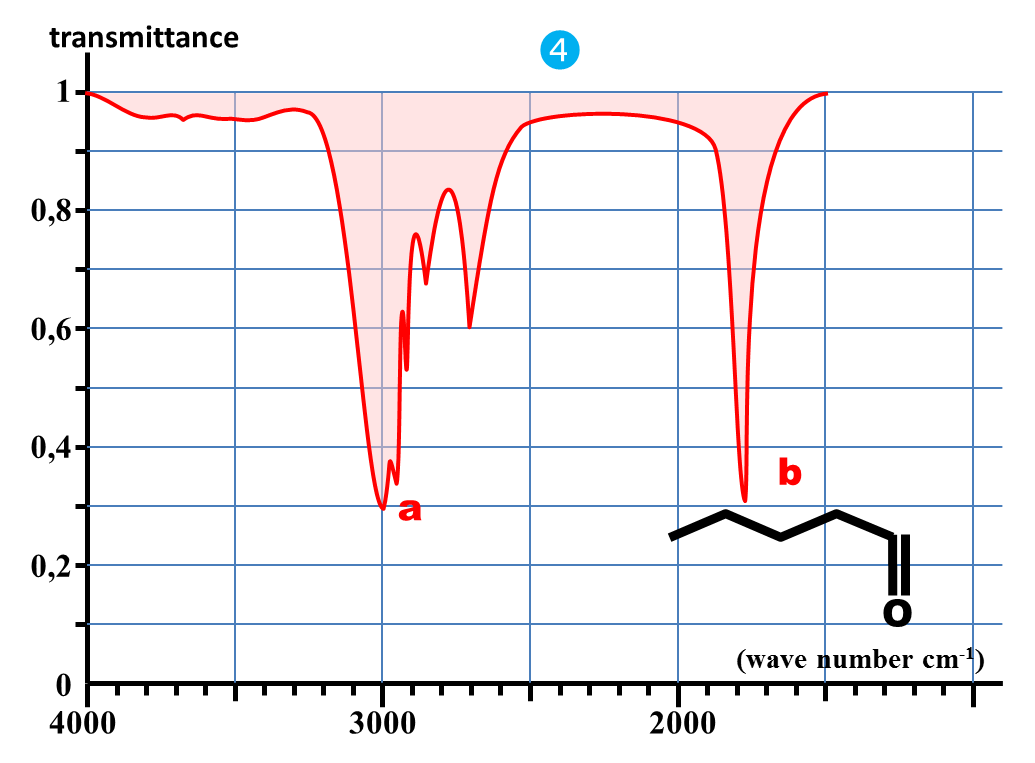
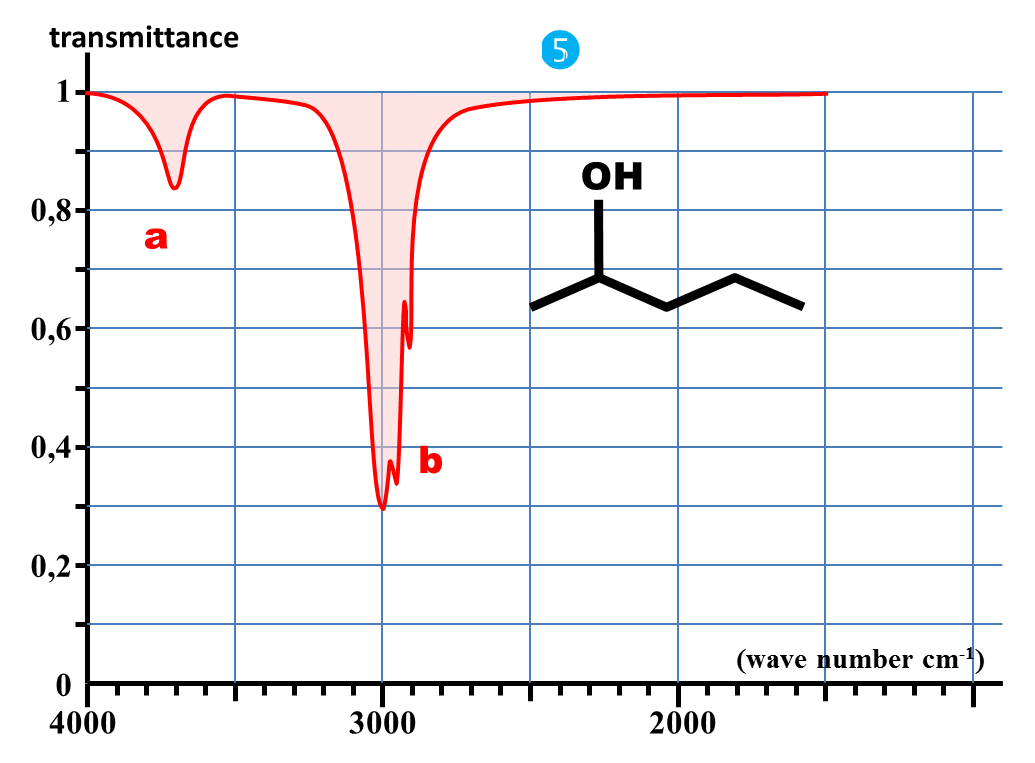
1. Nommer chaque molécule et donner leur représentation semi-développée.
2. Identifier la grandeur représentée en ordonnée. Quelle est son unité ?
3. Dans quel sens est orientée une bande d'absorption IR ?
4. Quelle est l'unité de la grandeur en abscisse ? A quelle grandeur peut-elle être liée ?
5. Quelle est la particularité de l'axe des abscisses ?
6. Quelle est la bande d'absorption commune à chaque spectre ?
7. A quelle caractéristique commune à chaque molécule peut-elle correspondre ?
A22. Analyser.
Le nombre s noté en abscisse est l'inverse de la longueur d'onde λ.
1. Vérifier que les spectres précédents ont été réalisés à des longueurs d'onde appartenant au domaine de l'infrarouge.
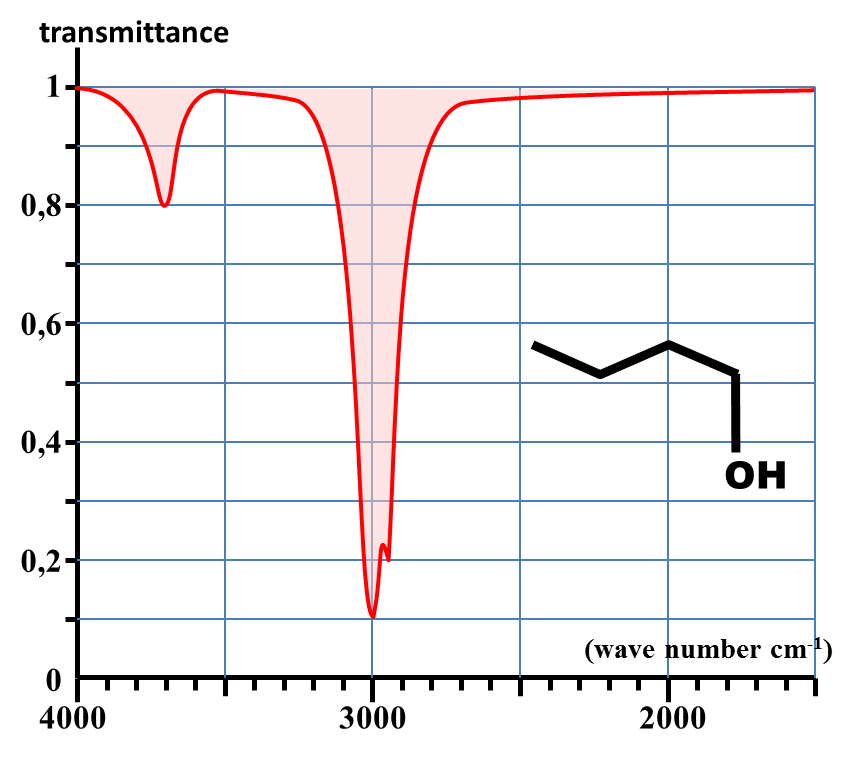
2. En spectroscopie IR, chaque bande d'absorption est caractéristique d'une liaison particulière.
Identifier la nature de la liaison responsable de la bande commune à tous les spectres précédents.
4. En déduire les valeurs approchées des nombres d'onde caractéristiques des absorptions dues aux liaisons C – H ; C = O et O – H.
|
||||||
A23. Observer.
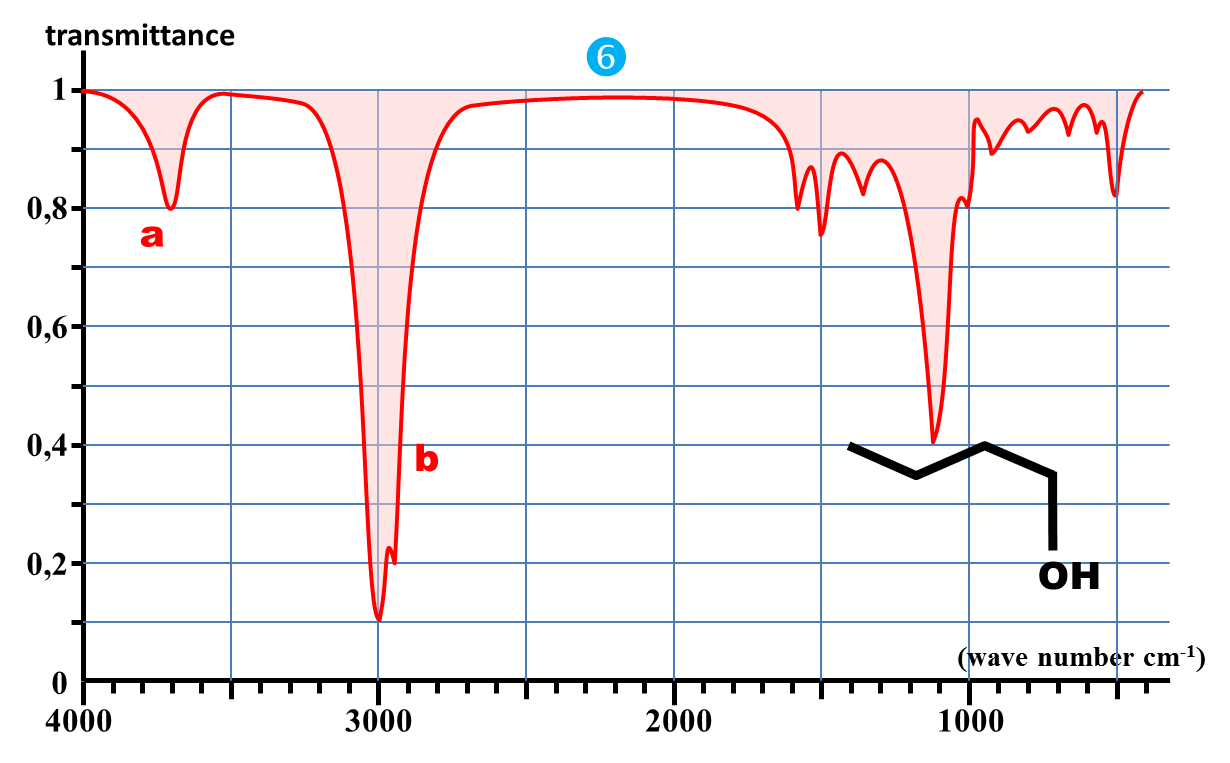
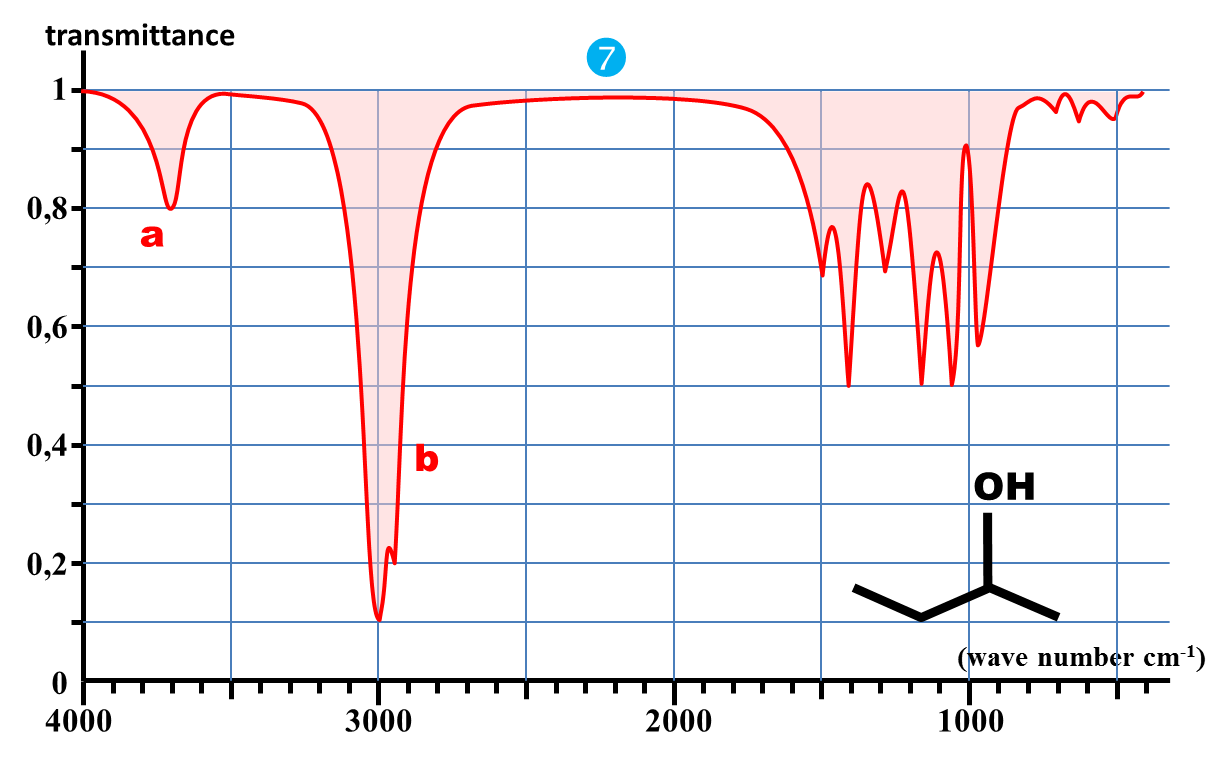
1. Nommer les molécules du document2.
2. Comparer les deux spectres 6 et 7.
3. Comparer les deux premiers spectres 6 et 7 avec le spectre 5.
A24. Analyser.
1. Vérifier que l'intégralité des nombres d'onde proposés correspond à des longueurs d'onde de l'IR.
2. Quelle information peut-on tirer de la partie des spectres du document 2 pour les plus grandes valeurs de nombres d'onde (σ > 1500 cm-1)
3. Que peut-on tirer à priori de l'autre partie (σ < 1500 cm-1).
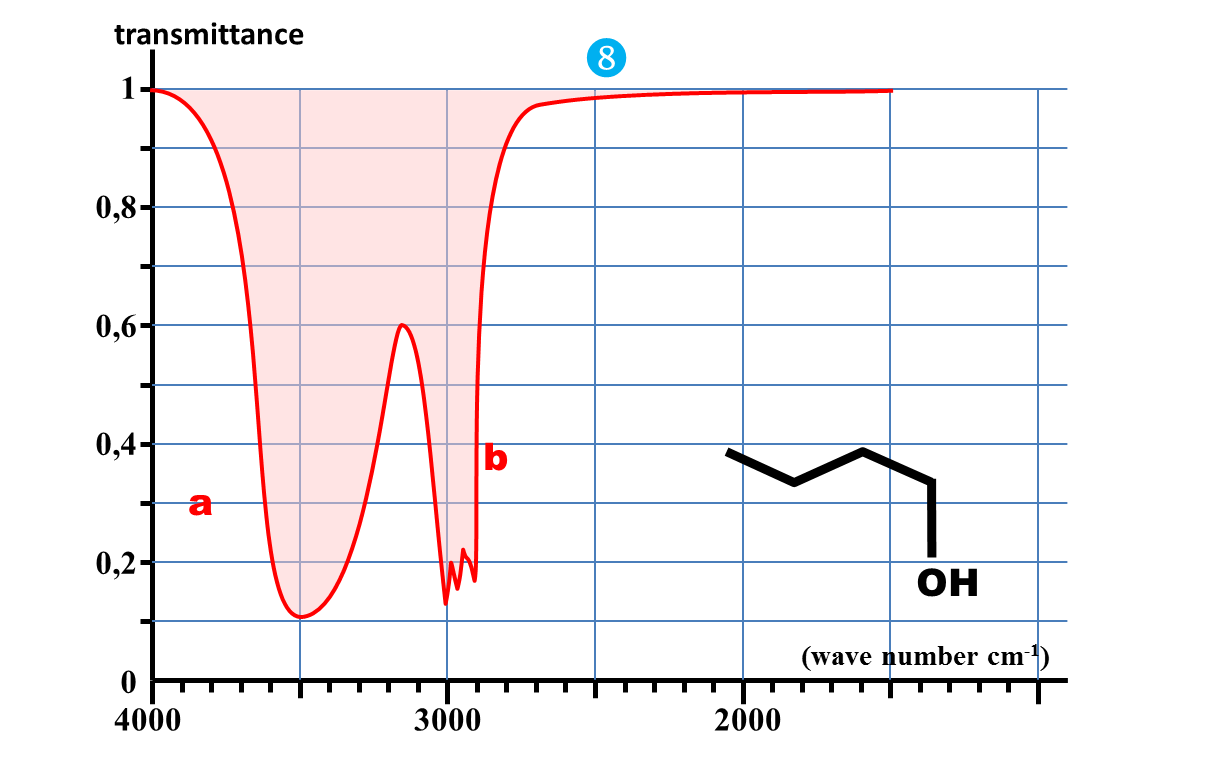
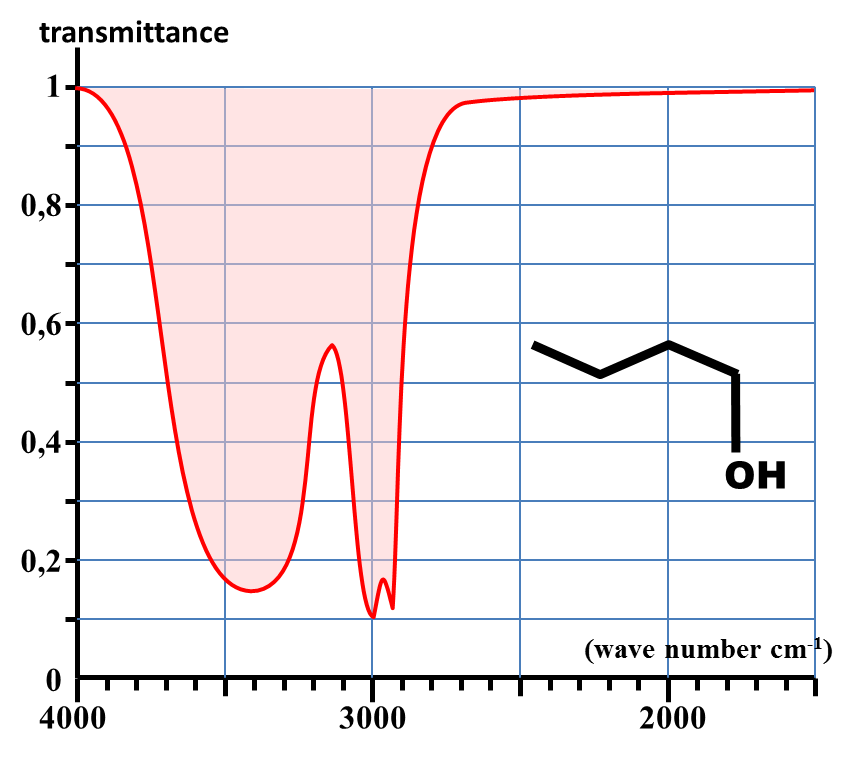
4a. En comparant les spectres des documents 2 et 3, dire quelle est l'influence de l'état physique de l'échantillon sur la bande d'absorption attribuée au groupent O – H.
b. Quelle interaction présente en phase condensée, mais pas en phase gazeuse est à l'origine de ce phénomène ?
COURS
C1 Spectroscopie d'absorption
C11 Principe
· Certaines molécules absorbent des radiations électromagnétiques dans le domaine du visible.
La plupart des espèces chimiques peuvent absorber aussi dans les domaines de l'infrarouge et de l'ultraviolet.
· Deux grandeurs sans dimension sont utilisées pour quantifier l'absorption du rayonnement :
- L'absorbance Aλ, grandeur positive.
- La transmittance Tλ, telle que : Tλ = 10 - Aλ (0 < Tλ < 1)
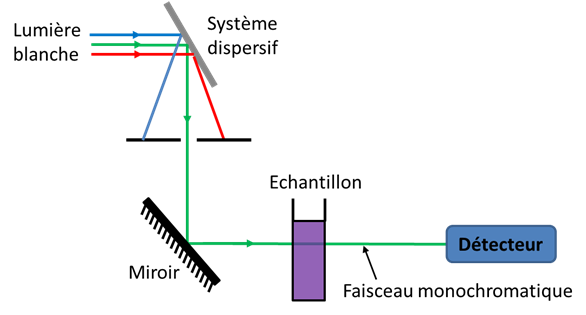
· Le spectrophotomètre envoie une lumière blanche sur l'échantillon à analyser.
L'étude de la lumière en sortie permet de déterminer les caractéristiques de la molécule étudiée
Les longueurs d'onde utilisées sont comprises entre 200 et 10000 nm.

C12 Spectroscopie UV-Visible
Le spectre d'une espèce unique dissoute dans un solvant contient une ou plusieurs larges bandes d'absorption. Chaque bande est caractérisée par :
- L'abscisse de son maximum λmax . Cette longueur d'onde est directement liée avec à la couleur de cette espèce.
- La valeur du coefficient d'absorption molaire εmax de cette espèce au maximum de l'absorbance Amax.
Amax = εmax . l. c
Amax : valeur de l'absorbance, sans unité.
l : largeur de la cuve en cm.
c : concentration de la solution en mol/L
εmax : en L.mol-1.cm-1
Le couple (λmax ; εmax) caractérise une espèce chimique absorbante dissoute dans un solvant donné et à une température donnée.
C2 Spectroscopie d'absorption Infrarouge
C21 Origine du spectre IR.
Lorsque des molécules sont soumises à des rayonnements infrarouges (entre 2500 et 25000 nm), les liaisons covalentes se mettent à vibrer différemment.
Les molécules absorbent alors ces rayonnements.
C'est la détection de ces absorptions que mesure l'absorption infrarouge.
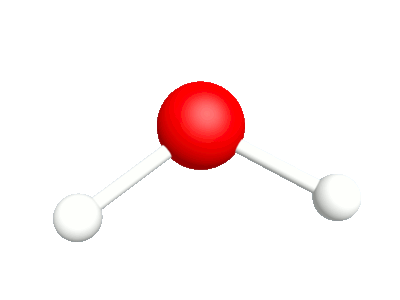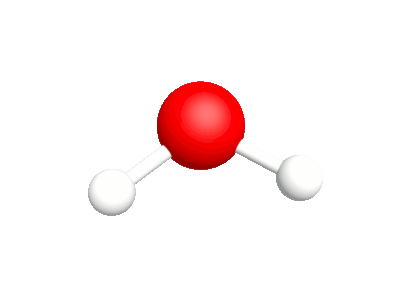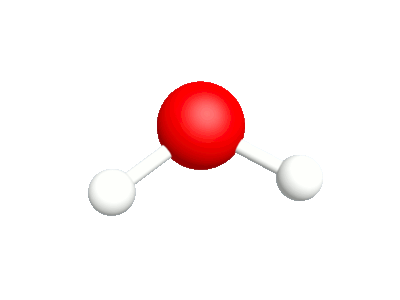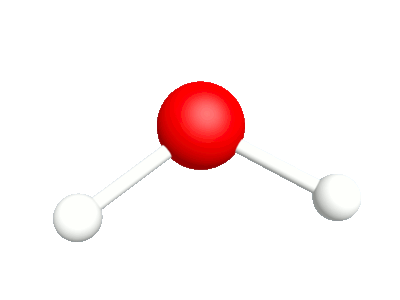
Différents modes vibratoires de la molécule d'eau
|
1a.Etirement asymétrique Les élongation et compression des liaisons sont en phase |
1b.Etirement symétrique Les élongation et compression des liaisons sont déphasées |
|
2a.Bascule Les rotations autour de l'atome d'oxygène sont en phase |
2b.Cisaillement Les rotations autour de l'atome d'oxygène sont déphasés |
|
3a.Agitation Les rotations hors du plan sont en phase |
3b.Torsion Les rotations hors du plan sont déphasées |
C22 Allure des spectres IR.
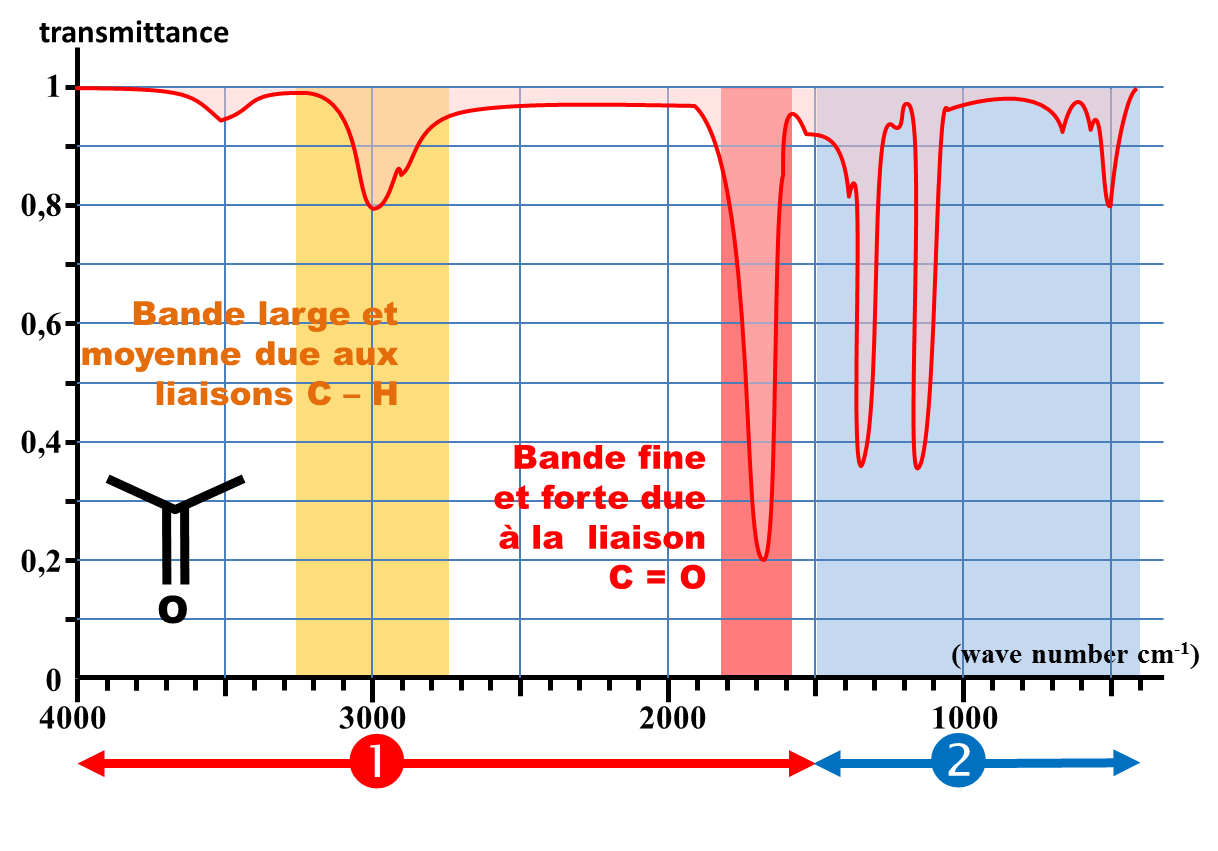
Les spectres IR présentent en général :
- Le nombre d'onde σ = 1/ λ en abscisse, exprimé en cm-1. L'échelle est orientée vers la gauche. Elle n'est pas toujours linéaire.
- La transmittance en ordonnée (ou parfois l'absorbance).
|
Chaque bande d'absorption est associée à un type de liaison, caractérisée par les deux atomes la constituant et sa multiplicité. |
C23 Exploitation des spectres IR.
|
zone 1 Nombre d'onde compris entre 1500 et 4000 cm-1 Cette zone ne contient qu'un nombre limité de bandes, correspondant à des types de liaisons particulier. Chaque bande est caractérisée par :
|
zone 2 Nombre d'onde compris entre 400 et 1500 cm-1 Il s'agit d'une zone très riche en bandes d'absorption pour les molécules organiques possédant plusieurs atomes de carbone. Elle n'est généralement exploitée qu'en comparaison avec un spectre de référence. Cette zone s'appelle l'empreinte digitale de la molécule. |
C231 Type de liaison.
Pour déterminer le type de liaison correspondant à une bande d'absorption :
- On relève sa position (abscisse).
- On s'intéresse à sa largeur.
- On s'intéresse à son intensité.
C232 Identification de la liaison.
On se reporte à la table des absorptions caractéristiques des liaisons.
|
Type de liaison |
Nombre d'onde σ (cm-1) |
Largeur de la bande |
Intensité |
|
O – H en phase gazeuse |
3500 – 3700 |
fine |
moyenne |
|
O – H en phase condensée |
3200 – 3400 |
large |
forte |
|
N – H en phase gazeuse |
3300 – 3500 |
fine |
faible |
|
N – H en phase condensée |
3100 – 3300 |
large |
forte |
|
C – H |
2900 – 3100 |
large |
moyenne à forte |
|
C = O |
1700 – 1800 |
fine |
forte |
|
C = C |
1500 – 1700 |
variable |
moyenne à forte |
Table simplifiée
|
La spectroscopie IR permet d'identifier la présence de certains types de liaisons au sein d'une molécule. La plupart du temps, elle permet d'en déduire la nature des groupes caractéristiques de cette molécule. |
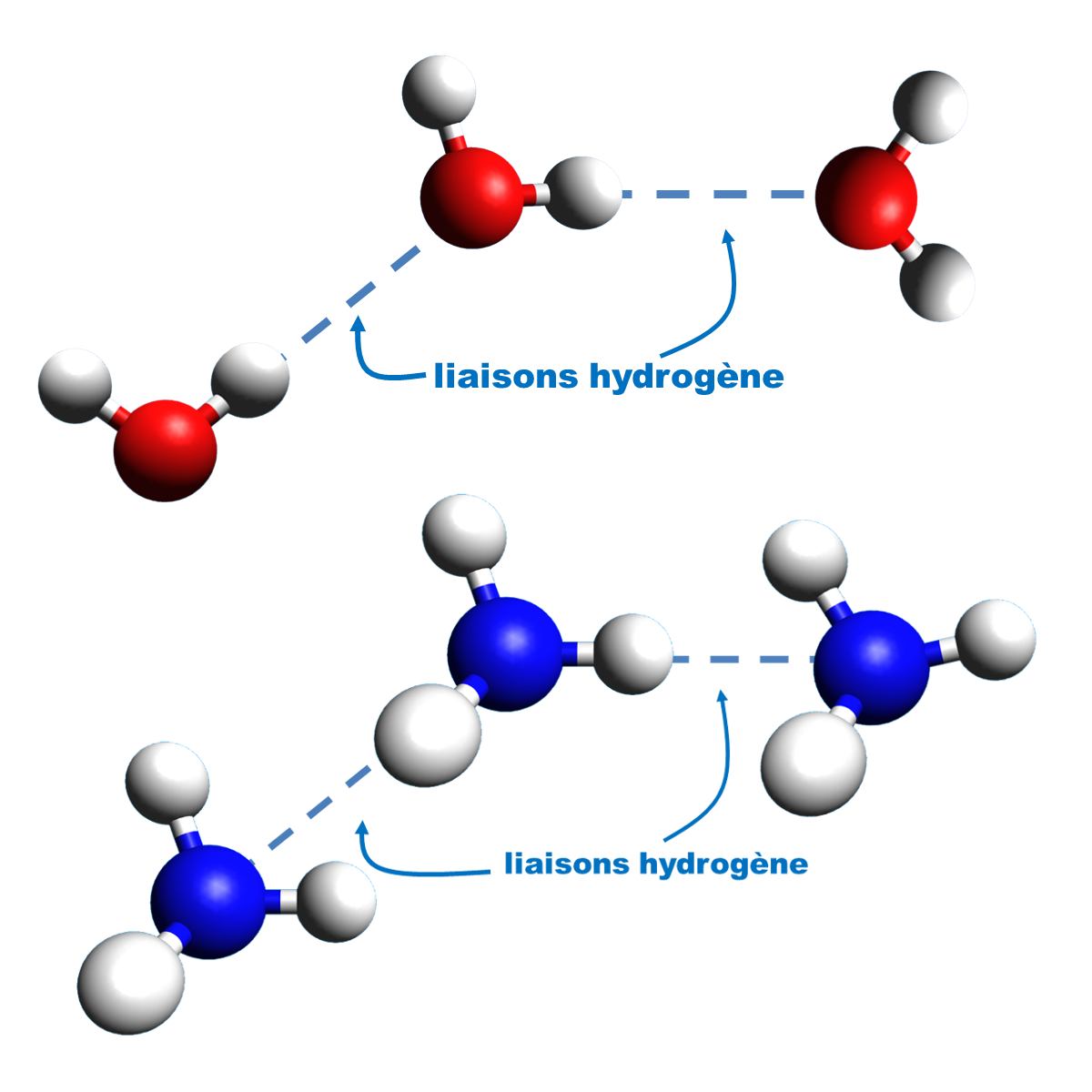
C24 Mise en évidence de la liaison hydrogène.
|
· En pratique, plusieurs facteurs (masses des atomes, conjugaison du système de liaisons…) influent sur la position et l'allure des bandes d'absorption.
· Ainsi, la bande fine et de faible absorption due à la liaison O – H en phase gazeuse (3600 cm-1) s'accompagne en phase condensée d'une bande très large et très intense autour de 3300 cm-1.
Cette très grande modification met en évidence la présence de liaisons hydrogène entre les molécules en phase condensée.
NB : Il peut s'agir de liaison O – H et/ou N – H.
|
|
|
Spectre d'absorption du butan-1-ol en phase gazeuse
|
Spectre d'absorption du butan-1-ol en phase condensée
|
Commentaires
-

- 1. Prof Le 26/03/2024
Merci pour les illustrations. Je les trouve intéressantes.-

- bob_coyoteLe 01/05/2024
Merci à vous
-

- 2. Gaspard Le 07/04/2023
Bonjour, savez vous où je peux trouver la correction de l'activité 1 svp.-

- bob_coyoteLe 16/04/2023
Bonjour. Il s'agit d'un TP réalisé en classe. Les résultats dépendent des mesures effectuées par les élèves. Si tu ne fais pas le TP, tu n'as pas de mesures, je ne peux pas corriger.
-

- 3. Grégory Serclier-Pieri Le 22/06/2020
Bonjour.
Excuse-moi, j'étais en train de modifier le site...
Il s'agit de calculer les longueurs d'onde correspondant aux nombres d'onde (en abscisse) et de vérifier que ces longueurs d'onde sont bien dans l'IR.
Attention cependant, les nombres d'onde sont donnés en cm-1 !!
-

- 4. cabart Le 19/03/2020
Bonjour, je n'arrive pas a répondre à la question "A24. Analyser.
1. Vérifier que l'intégralité des nombres d'onde proposés correspond à des longueurs d'onde de l'IR."
Pouvez vous m'aider svp.
Ajouter un commentaire