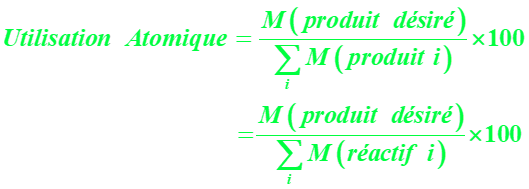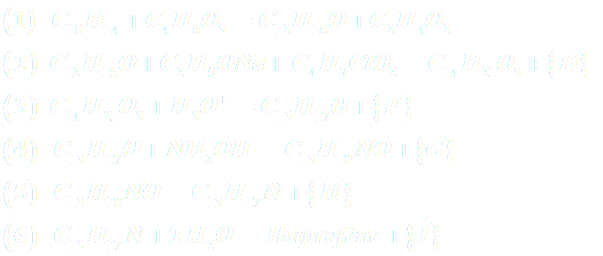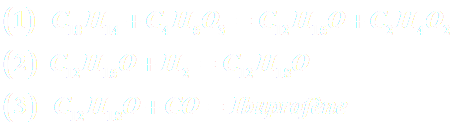Chimie organique
ACTIVITES
A1 Synthèse du paracétamol.
A11 Le paracétamol.
|
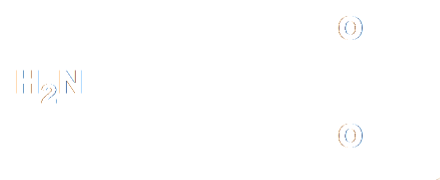
· Le paracétamol est le principe actif de nombreux médicaments (Doliprane, Efferalgan...). Il se rapproche de l’aspirine par ses propriétés analgésiques et antipyrétiques mais il n’en présente pas les contre-indications (lésions de la muqueuse gastrique, retard à la coagulation du sang). · Le paracétamol est un solide blanc, peu soluble dans l'eau, dont la température de fusion est 168 °C. Il peut être synthétisé par réaction entre le para-aminophénol et l’anhydride acétique selon la réaction d’équation : |
 |

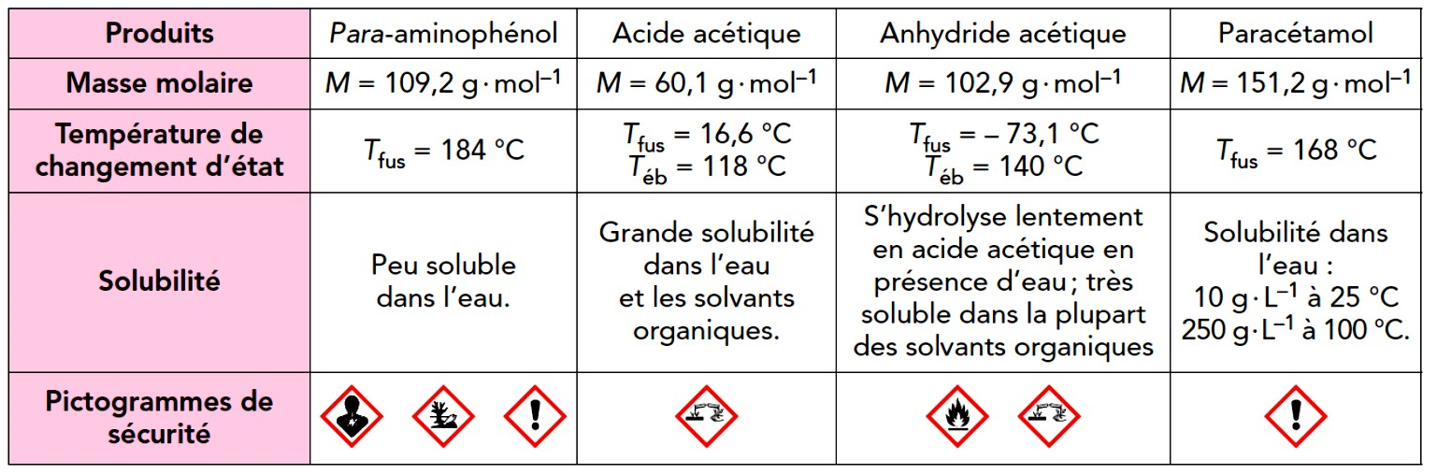
A11a. Recopier l’équation de la réaction de synthèse du paracétamol.
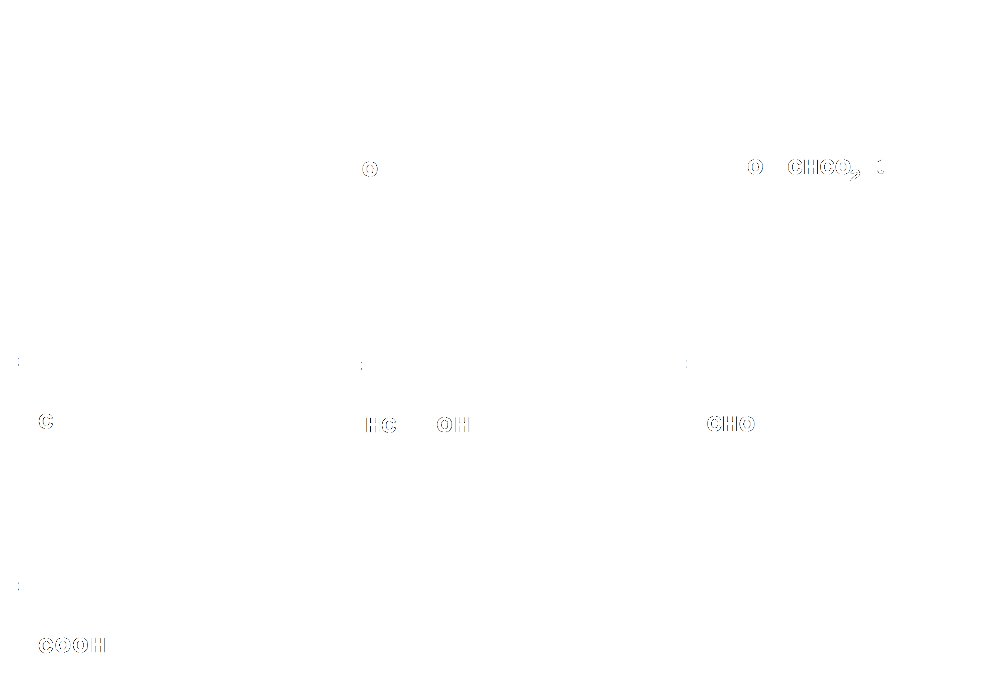
Entourer et nommer les groupes caractéristiques présents dans le para-aminophénol et le paracétamol.
Avec quel groupe du para-aminophénol, l’anhydride acétique réagit-il ?
À quelle grande catégorie de réaction chimique appartient cette réaction ?
A11b. Lors de la réaction entre le para-aminophénol et l’anhydride acétique, le paracétamol se forme majoritairement. Mais une autre espèce chimique peut se former minoritairement si l’anhydride acétique réagit avec le groupe hydroxyle du para-aminophnéol. En s’inspirant de l’équation de la réaction de synthèse de l’aspirine, donnée ci-dessous, écrire la formule topologique de cette espèce minoritaire.

A11c. On dit que le paracétamol est obtenu via une réaction sélective : à l’aide de cet exemple définir une réaction sélective et un réactif chimiosélectif.
A12 Etapes de la synthèse du paracétamol.
|
A12a. Etape préliminaire : Observer les pictogrammes des réactifs utilisés. Rechercher les risques inhérents à leur manipulation. S'organiser en conséquence. |
 |
1ère Etape : Synthèse.
· Préparer un bain marie d’eau chaude en remplissant, au tiers, un récipient en verre avec de l’eau chaude.
· Placer le récipient sur un agitateur magnétique chauffant.
· Dans un erlenmeyer de 250 mL, introduire 2,72 g de para-aminophénol (pré-pesé) et environ 20 mL d'une solution d'acide acétique à 2 mol.L-1 à l'aide d'une éprouvette graduée. La solution d’acide acétique sert à dissoudre le para-aminophénol.
· Boucher l'erlenmeyer et agiter doucement à la main l'erlenmeyer pour commencer la dissolution.
· Adapter un réfrigérant à air au montage et placer l'erlenmeyer dans le récipient en verre. Mettre en route une agitation modérée pendant une dizaine de minutes, et chauffer à environ 100°C jusqu'à dissolution totale du para-aminophénol.
· Une fois tout le para-aminophénol dissous, retirer l'erlenmeyer du bain-marie, le laisser refroidir à l'air puis dans un bain marie d’eau froide.
· Ajouter, progressivement, V = 3,5 mL d’anhydride acétique tout en agitant. Laisser cristalliser. Gratter le fond de l’erlenmeyer à l’aide d’une baguette en verre pour favoriser la cristallisation.
A12b. Justifier les étapes de chauffage puis de refroidissement du mélange.
A12c. Quelle masse maximale de paracétamol peut-on espérer obtenir lors de cette synthèse ? Donnée : masse volumique de l’anhydride acétique ρaa = 1,08 g.mL-1.
|
2ème Etape : Séparation. · Filtrer sous pression réduite le produit cristallisé et le rincer à l’eau glacée. · Sécher le produit brut entre deux morceaux de papier filtre. · Peser le produit brut obtenu. |
 |
A12d. Quel est l’avantage d’une filtration sur Büchner par rapport à une filtration simple ?
A12e. Pourquoi rince-t-on à l’eau glacée ?
A12f. Calculer le rendement de la réaction de synthèse en considérant que le produit brut n’est constitué que de paracétamol.
|
3ème Etape : Caractérisation. A12g. Température de fusion : mesurer les points de fusion du produit brut obtenu après séchage (Manip prof). |
 |
|
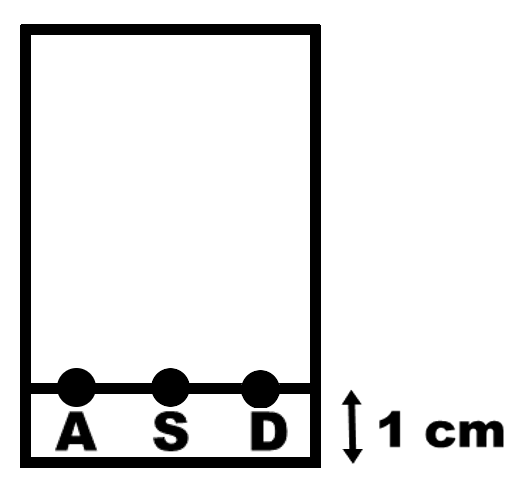
Chromatographie sur couche mince : A: solution de para-Aminophénol dans d’acétate de butyle : déjà prête sur paillasse professeur. S: solution du Solide de synthèse dans d’acétate de butyle : à préparer dans un mini-tube. D: solution du médicament Doliprane contenant du paracétamol : déjà prête sur paillasse professeur. Eluant : mélange d’acétate de butyle (3 mL), de cyclohexane (2,0 mL), d’acide formique (0,5 mL) et d’acétone (10 gouttes). · Réaliser les dépôts A, S et D sur la ligne de dépôt de la plaque CCM · Vérifier vos dépôts à l’aide d’une lampe UV. · Après élution jusqu’à 1 cm du haut de la plaque, révéler les taches avec la lampe à UV. |
 |
|
A12h. Reproduire et analyser le chromatogramme obtenu. A12i. Le spectre RMN ci-contre peut-il être celui du paracétamol ? Justifier. |
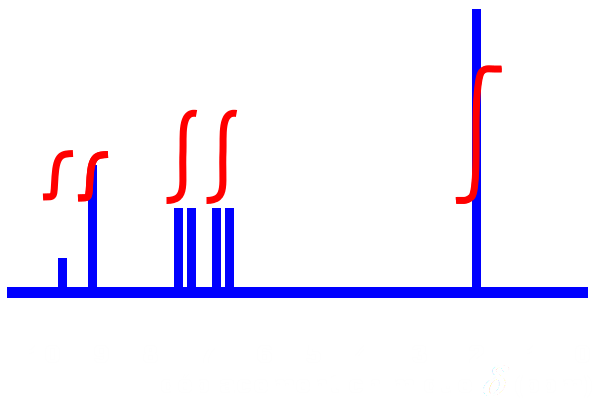 |
A2 Synthèse de la benzocaïne.
A21 Etude de la molécule de benzocaïne.
|
Benzocaïne |
A21a. Recopier la formule ci-contre et entourer les groupes caractéristiques. A21b. Le nom systématique de la benzocaïne est : 4-aminobenzoate d'éthyle. Donnant les arguments justifiant le nom de cette molécule. |
A22 Synthèse de la benzocaïne.
La synthèse de la benzocaïne à partir du 4-nitrotoluène peut se décomposer en 3 étapes :
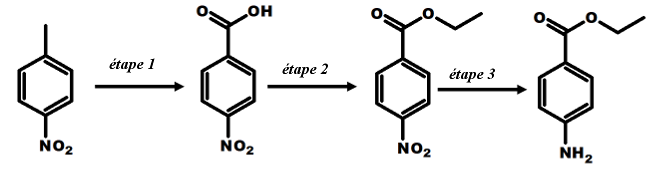
1ère Etape :
Pour réaliser l’étape 1 sur le 4-nitrotoluène deux protocoles sont possibles :
|
Protocole 1 : Dans un ballon tricol de 500 mL, contenant déjà 46 g de dichromate de potassium dihydraté, muni d’une agitation mécanique, d’un réfrigérant à reflux et d’une ampoule de coulée, introduire 16 g de 4-nitrotoluène ainsi que 100 mL d’eau. Ajouter, sous vive agitation, en 10 minutes environ, 60 mL d’acide sulfurique concentré au moyen de l’ampoule de coulée. Lorsque tout l’acide a été introduit, porter doucement à ébullition pendant vingt minutes, à l’aide d’un chauffe-ballon. Il est important de ne pas trop chauffer sinon les ions sulfate forment avec les ions chrome (III) une épaisse mousse qui risque de provoquer le débordement du ballon et d’altérer le produit de la réaction. Il faut également noter que si le système d’agitation est défaillant, il se forme une croûte de 4-nitrotoluène dans le ballon et le rendement peut s’en trouver diminué. Il peut se former aussi un dépôt blanc dans le réfrigérant. Refroidir puis verser avec précautions le mélange réactionnel dans 200 mL d’eau glacée. L’acide 4- nitrobenzoïque précipite. Filtrer sur büchner et laver le solide obtenu avec 100 mL d’eau. Rendement : 80% D’après http://www.educnet.education.fr/rnchimie/conc_gen/annales/05/tp_cg_05_orga.pdf |
Protocole 2 : 0,5 g de 4-nitrotoluène et 0,72 g de permanganate de potassium sont additionnés à une solution d’hydroxyde de sodium (1,2 g dans 0,18 L). Le mélange est agité et chauffé à reflux pendant 15 minutes. La solution est ensuite refroidie et de l’éthanol est additionné (env. 2 mL) jusqu’à la disparition complète de la couleur violette. Le dioxyde de manganèse, solide marron est séparé du milieu réactionnel par filtration. Le filtrat incolore est refroidi dans la glace et de l’acide chlorhydrique est additionné (17 mL) jusqu’à précipitation complète. L’acide 4-nitrobenzoïque est séparé par filtration et lavé avec de l’eau froide. Rendement : 70%.
D’après |
|
Indications figurant sur l’étiquette du récipient contenant le permanganate de potassium :
Phrases R : 8-22 Favorise l'inflammation des matières combustibles. Nocif en cas d'ingestion. Phrases S : ---
En cas d'inhalation : faire respirer de l'air frais. En cas de malaise, consulter un médecin. En cas de contact avec la peau : laver abondamment à l'eau. Enlever les vêtements souillés. En cas de contact avec les yeux : rincer abondamment à l'eau, en maintenant les paupières écartées. Consulter un ophtalmologiste. En cas d'ingestion : faire boire beaucoup d'eau, provoquer le vomissement, consulter un médecin.
Indications figurant sur l’étiquette du récipient contenant le dichromate de potassium :
Phrase(s)-R: 49-46-21-25-26- 36/38-41-43-50/53 Peut provoquer le cancer par inhalation. Peut provoquer des altérations génétiques héréditaires. Nocif par contact avec la peau. Toxique en cas d'ingestion. Très toxique par inhalation. Irritant pour les voies respiratoires et la peau. Risque de lésions oculaires graves. Peut entrainer une sensibilisation par contact avec la peau. Très toxique pour les organismes aquatiques, peut entrainer des effets néfastes à long terme pour l'environnement aquatique.
Phrase(s)-S: 53-45-60-61 Eviter l'exposition. Se procurer des instructions spéciales avant l'utilisation. En cas d'accident ou de malaise consulter immédiatement un médecin (si possible lui montrer l'étiquette). Eliminer le produit et son récipient comme un déchet dangereux. Eviter le rejet dans l'environnement. Consulter les instructions spéciales / la fiche de données de sécurité.
En cas d'inhalation : faire respirer de l'air frais. Consulter un médecin. En cas de contact avec la peau : laver abondamment à l'eau. Enlever les vêtements souillés. En cas de contact avec les yeux : rincer abondamment à l'eau, en maintenant les paupières écartées (au moins 10 minutes). Consulter immédiatement un ophtalmologiste. En cas d'ingestion : boire immédiatement beaucoup d'eau, puis du lait, tenter de faire vomir, dégager les voies respiratoires, consulter un médecin.
Prix du permanganate de potassium : environ 130 €/kg. Prix du dichromate de potassium : environ 180 €/kg. |
A22a. Comment s’appelle le produit obtenu à l’issue de l’étape 1 ?
A22b. En utilisant les documents ci-dessus, comparer les avantages et les inconvénients de ces deux protocoles (rendement, temps de réaction, toxicité et coûts des produits chimiques utilisés).
2ème Etape :
A22c. A quelle grande catégorie de réactions en chimie organique appartient l’étape 2 de la synthèse de la benzocaïne ?
A22d. Le mécanisme de cette réaction est détaillé ci-dessous :
Pour les étapes (a) et (b) du mécanisme, identifier les sites donneurs et accepteurs d’électrons et représenter les transferts électroniques à l’aide du formalisme des flèches courbes.
A22e. Lors de cette étape 2, on utilise de l’acide sulfurique qui apporte les ions H+ nécessaires. Peut-on considérer l’acide sulfurique comme un réactif lors de cette transformation ? Donner une réponse argumentée.
3ème Etape :
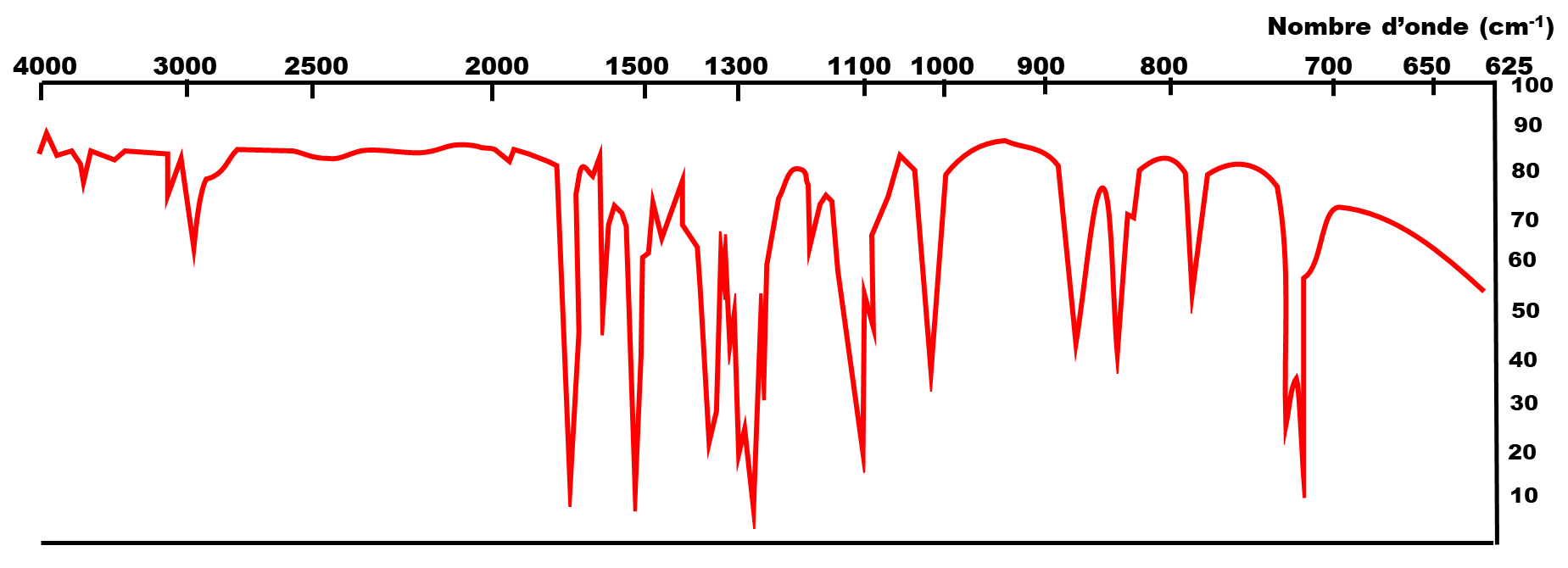
Spectre infrarouge du 4-nitrobenzoate d'éthyle :
Spectre infrarouge du 4-aminobenzoate d’éthyle ou benzocaïne :
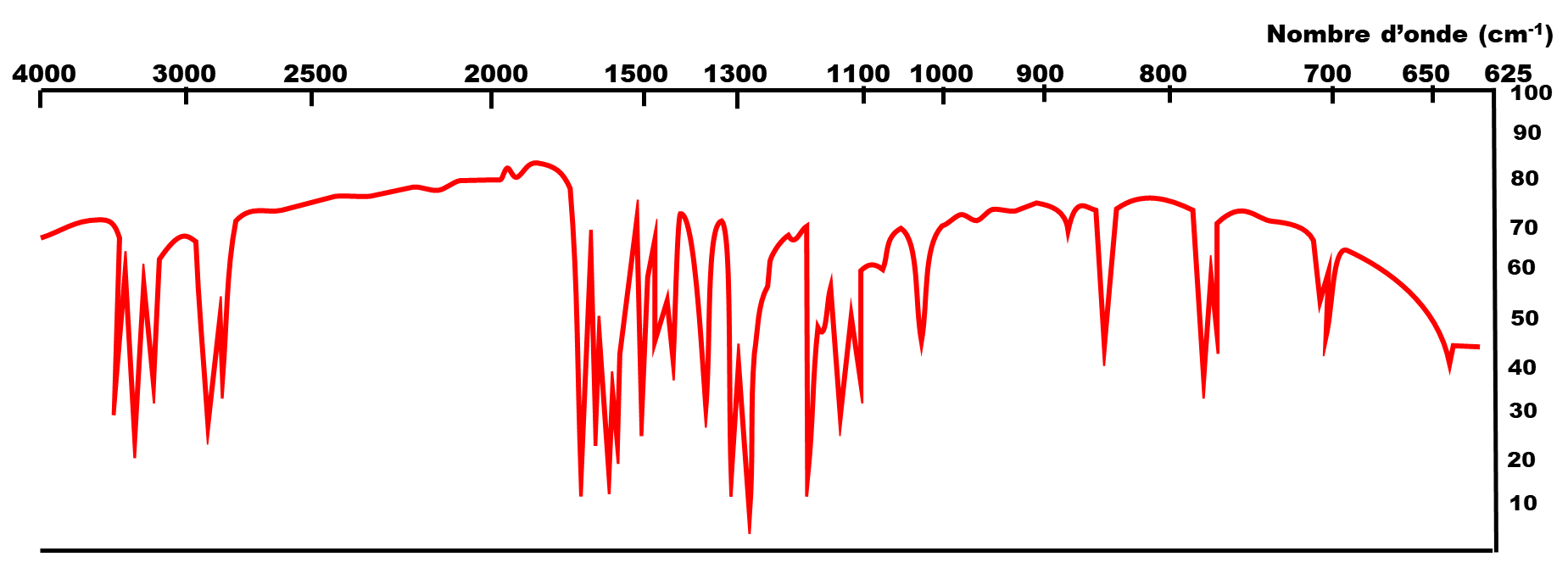
Table de données (spectroscopie IR) :
| Liaison | Nombre d'onde (cm-1) |
| O - H | 3200 - 3670 |
| C = O ester | 1700 - 1740 |
| N - H | 3100 - 370 |
| N = O | 1510 - 1580 et 1325 - 1375 |
A22f. A l’aide des spectres infrarouge et de la table de données ci-dessous, mettre en évidence la transformation subie lors de la troisième étape de la synthèse de la benzocaïne.
A3 Stratégie en chimie organique : synthèse de l'apsirine.
La synthèse d’une espèce chimique comporte en général plusieurs étapes, mettant en jeu les mêmes techniques.
On va réaliser la synthèse d’un médicament usuel, l’aspirine (acide acétylsalicylique). L’aspirine est connue pour ses propriétés antalgiques, antipyrétiques et anti-inflammatoires. Il est aussi utilisé comme antiagrégant plaquettaire.
Document 1 : Techniques utilisées.
|
Doc1a. Chauffage au bain-marie :
|
Doc1b. Purification du produit par recristallisation :
Cette technique est fondée sur la différence des solubilités à chaud et à froid entre l’espèce chimique d’intérêt et les espèces à éliminer. Le produit à purifier est dissous dans un solvant chaud bien choisi. On laisse ensuite le mélange refroidir très lentement. Les impuretés restent dissoutes dans le solvant alors que le produit cristallise lentement. Il reste ensuite à effectuer une filtration. |
|
Doc1c. Filtration sur Büchner :
Il s'agit d'une filtration rapide, effectuée sous pression réduite. |
|
Doc2. Synthèse : |
 |
Doc 3 : Données physico-chimiques :
|
Espèce chimique |
M(g/mol) |
θ chgt état |
d |
Solubilité |
Sécurité |
|
|
Acide salicylique |
Acide 2-hydroxybenzoïque |
138 |
θf =159°C |
1,44 |
Peu soluble dans l'eau |
|
|
Anhydride éthanoïque |
102 |
θéb =136°C |
1,08 |
Réagit violemment avec l'eau formant de l'acide acétique |
|
|
|
Acide acétylsalicylique |
Acide 2-acétylhydroxybenzoïque |
180 |
θf =140°C |
1,40 |
Très peu soluble dans l'eau à 20°C, soluble à 60°C. Très soluble dans l'éthanol. |
|
|
Acide acétique |
Acide éthanoïque |
60 |
θéb =118°C |
1,08 |
Très soluble dans l'eau |
|
|
Acide sulfurique concentré |
98 |
|
|
|
|
|
|
Doc 4 : Premier protocole de synthèse de l'acide acétylsalicylique · Réaliser la synthèse de l’aspirine en utilisant 3,0 g d’acide salicylique et 7,0 mL d’anhydride éthanoïque (alors introduit en excès) en présence d’acide sulfurique concentré (5 gouttes). Chauffer au bain marie d’eau distillée durant 15 min à maximum 60°C. Remarque : l’erlenmeyer doit être bien sec. · Faire cristalliser l’aspirine : laisser refroidir le mélange puis ajouter lentement 70 mL d’eau froide. · Récupérer l’aspirine cristallisée. Conserver un peu de cette aspirine non purifiée. · Purifier l’aspirine par recristallisation. · Effectuer un contrôle de qualité par CCM. Les solides seront dissous dans un peu d’éthanoate d’éthyle avant dépôt sur la plaque. |
|
Doc 5 : Chromatographie sur couche mince.
|
|
A31 Analyse du premier protocole.
A31a. Quel est l’intérêt du chauffage au bain marie ?
A31b. Comment peut-on purifier un mélange homogène formé de plusieurs liquides ?
A31c. Pour extraire un solide d’un mélange liquide, on peut effectuer une filtration. Quelle méthode utiliser pour extraire un soluté d’un mélange homogène ? Décrire le procédé.
A31d. À quoi sert l’acide sulfurique concentré ajouté en petite quantité ?
A31e. Pourquoi l’erlenmeyer utilisé doit-il être bien sec ?
A31f. Montrer que l’anhydride éthanoïque est en excès. Déterminer alors les espèces présentes dans le milieu réactionnel en fin de réaction.
A31g. Analyser les résultats de la CCM. L’étape de purification par recristallisation est-elle utile ?
A31h. Donner une autre méthode permettant de contrôler la pureté du produit obtenu.
A32 Analyse du deuxième protocole.
A32a. Pourquoi n’utilise-t-on pas ce protocole au niveau du lycée ?
A32b. Pourquoi faut-il à la fois que la verrerie soit sèche et que le milieu réactionnel ne soit pas au contact de l’air ?
A32c. Rechercher le prix de l’anhydride éthanoïque et du chlorure d’éthanoyle (chlorure d’acétyle). Conclure sur le coût et la sécurité de chacune des synthèses.
A4 La chimie verte.
Document 1 : les 12 principes de base.
Les 12 principes de la chimie verte ont été développés à l’origine par des ex agents de la EPA ( l’agence américaine de protection de l’environnement ), Paul Anastas et John Warner, dans Green Chemistry: Theory and Practice. Ces principes tracent la feuille de route pour les chimistes en vue d’instaurer une logique chimie verte dans leurs actions.
|
N° |
Description |
|
|
Les synthèses doivent être conçues dans le but de maximiser l'incorporation des matériaux utilisés au cours du procédé dans le produit final. |
|
|
Lorsque c'est possible, il faut supprimer l'utilisation de substances auxiliaires (solvants, agents de séparation…) ou utiliser des substances inoffensives. |
|
|
Les besoins énergétiques des procédés chimiques ont des répercussions sur l'économie et l'environnement dont il faut tenir compte et qu'il faut minimiser. Il faut mettre au point des méthodes de synthèse dans les conditions de température et de pression ambiante. |
|
|
Les méthodes de synthèse doivent être conçues pour utiliser et créer des substances faiblement ou non toxiques pour les humains et sans conséquence sur l'environnement. |
|
|
Les réactifs catalytiques sont plus efficaces que les réactifs stœchiométriques. Il faut favoriser l'utilisation de réactifs catalytiques les plus sélectifs possibles. |
|
|
Il vaut mieux produire moins de déchets qu'investir dans l'assainissement ou l'élimination des déchets. |
|
|
Les produits chimiques doivent être conçus de manière à remplir leur fonction primaire tout en minimisant leur toxicité. |
|
|
Lorsque la technologie et les moyens financiers le permettent, les matières premières utilisées doivent être renouvelables plutôt que non-renouvelables. |
|
|
Les substances et la forme des substances utilisées dans un procédé chimique doivent être choisies de façon à minimiser les risques d'accidents chimiques incluant les rejets, les explosions et les incendies. |
|
|
Des méthodologies analytiques doivent être élaborées afin de permettre une surveillance et un contrôle en temps réel et en cours de production avant qu'il y ait apparition de substances dangereuses. |
|
|
Les produits chimiques doivent être conçus de façon à pouvoir se dissocier en produits de dégradation non nocifs, cela dans le but d'éviter leur persistance dans l'environnement. |
|
|
Lorsque c'est possible, toute déviation inutile du schéma de synthèse (utilisation d'agents bloquants, protection/déprotection, modification temporaire du procédé physique/chimique) doit être réduite ou éliminée. |
Document 2 : l'économie d'atomes.
|
Objectif : · Maximiser le nombre d'atomes de réactifs transformés en produits au cours de la synthèse. · Réduire la quantité de résidus de réaction, voire les supprimer
|
Document 3 : Ibuprofène.
|
PROCEDES DE PRODUCTION DE L'IBUPROFENE |
||||
|
|
|||
Ibuprofène :  |
A41. Faire correspondre les numéros du diagramme des principes de la chimie verte avec les données du tableau (document 1).
A42. Donner la formule brute de l’ibuprofène et calculer sa masse molaire.
A43. L'utilisation atomique correspond au rapport de la masse molaire du produit recherché sur la somme des masses molaires de tous les produits qui apparaissent dans l'équation stœchiométrique. Si les sous-produits de la réaction ne sont pas tous identifiés, alors la conservation de la matière permet de remplacer le dénominateur par la somme des masses molaires de tous les réactifs. Dans la synthèse BOOTS, les sous-produits ont été remplacés au niveau des différentes étapes par :{D}, {F}, {G}, {H}, {I} (document 3)
A43a. Etablir l’équation de la réaction traduisant la somme des 6 étapes.
A43b. Evaluer la somme des masses molaires de tous les réactifs.
M(N) = 14,0 g.mol-1 ; M(Na) = 23,0 g.mol-1 ; M(Cl) = 35,5 g.mol-1; M(O) = 16,0 g.mol-1 ; M(H) = 1,00 g.mol-1 ; M(C) = 12,0 g.mol-1.
A43c. En déduire en pourcentage l’UA de ce procédé
A44. Procédé BHC. Ce procédé met en jeu 3 étapes, en faisant appel à des réactions catalysées.
A44a. Rappeler ce qu’est un catalyseur.
A44b. En procédant comme pour le procédé BOOTS, évaluer le pourcentage d'utilisation atomique du procédé BHC.
A44c. Comparer les 2 procédés relativement à la charte de la chimie verte.
A45. Le facteur E comme "Effluent" ou "Déchet" peut être défini comme étant le rapport de la masse de tous les déchets et sous-produits par la masse de produit désiré. Donc, le E-facteur est la mesure de la quantité de déchets produits pour fabriquer un produit donné comparé à la quantité de ce même produit final (utilisable).
A45a. Montrer que la relation liant le pourcentage d'utilisation atomique (%U.A.) au facteur E est donné par : 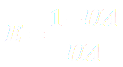
A45b. Calculer E1 et E2 pour les 2 réactions précédentes.
A46. « Pour le procédé BOOTS, Pour former 13 000 tonnes d’Ibuprofène, on produit 20 000 t de déchets. Pour le procédé HBC : Pour former 13 000 tonnes, on produit 4 000 t de sous-produits valorisés par leur utilisation dans les peintures. » Retrouve-t-on les résultats (Utilisation atomique et facteur E) trouvées précédemment. Quel autre avantage trouve-t-on dans le deuxième procédé en accord avec quels principes de la chimie verte ?
COURS
C1 Stratégies de synthèse en chimie organique.
C11 Etape préliminaire.
Pour synthétiser un composé organique, il faut choisir :
- les réactifs appropriés ainsi que leurs quantités. Le plus souvent, l'un des deux réactifs est introduit en excès; il s'agit en général du moins cher;
- un solvant adapté qui doit permettre de solubiliser les réactifs et de contrôler la température dans le milieu réactionnel;
- un catalyseur afin d'accélérer la réaction;
- les paramètres expérimentaux (température, durée de la réaction, etc.);
- le montage adapté à la réaction.
NB : Si tout doit être mis en œuvre pour avoir le meilleur rendement possible, il faut aussi prendre en compte les aspects liés à la sécurité en exploitant les pictogrammes et les consignes de sécurité relatifs aux espèces chimiques utilisées.
Le coût de la synthèse et l'impact sur l'environnement doivent aussi être évalués.
C12 Etape 1 : la réaction.
La mise en œuvre consiste en la préparation dans un "réacteur" (ballon, erlenmeyer) du mélange réactionnel.
Les prélèvements des réactifs s'effectuent en suivant les précautions de sécurité liées à leurs dangerosités (utilisation ou non de gants, de lunettes, de la hotte) avec le choix de verrerie adaptée.
En fin de réaction, le réacteur contient un mélange d'espèces chimiques, dont celle recherchée.
|
· Certaines réactions peuvent avoir lieu à froid dans le cas où on souhaite éviter une élévation de température, due à une réaction qui dégage trop de chaleur.
· D'autres réactions nécessitent un chauffage qui permet d'accélérer la réaction, on effectue alors un chauffage à reflux. Le chauffage permet aussi de dissoudre les réactifs solides et d'augmenter le rendement de certaines réactions limitées. |
 |
Exemple :
Le chauffage à reflux permet de chauffer le mélange réactionnel et donc d’accélérer la transformation chimique car la température est un facteur cinétique.
Le réfrigérant à boules permet de condenser (liquéfie) les vapeurs formées qui retombent (refluent) dans le ballon.
Ainsi le volume du milieu réactionnel reste constant et cela permet d’éviter les pertes de matière ainsi que la libération de vapeurs nocives.
C13 L'isolement.
En fin de réaction, on refroidit le mélange réactionnel pour diminuer la solubilité du produit s'il est solide.
L'isolement consiste à séparer au mieux le produit des réactifs n'ayant pas réagi, des produits secondaires, du catalyseur, du solvant et des sous-produits dus à des réactions parasites. L'isolement conduit au produit brut.
Différentes techniques sont utilisées selon l'état du produit à isoler :
|
C13a. Filtration sur Büchner (pression réduite) Cette technique permet l'isolement d'un solide (cristallisation) Un entonnoir Büchner est généralement en porcelaine et présente un fond plat et percé (un peu comme une passoire !). Le papier filtre est déposé sur le fond plat et humecté avec du solvant afin qu'il épouse bien la forme de l'entonnoir. Celui-ci est ensuite placé sur une fiole à vide (erlenmeyer en verre épais muni d'une sortie pour pouvoir effectuer le vide). Un adaptateur de forme conique en caoutchouc permet de faire l'étanchéité. |
 |
|
C13b. Extraction liquide-liquide à l'aide d'une ampoule à décanter. Elle permet de transférer sélectivement es espèces présentes dans un solvant vers un autre solvant, non miscible au premier, dans lequel elles sont plus solubles. Lorsque le produit synthétisé est très soluble dans la phase organique, on peut, pour améliorer la séparation :
· saturer la phase aqueuse en sels (par exemple Na+(aq) + Cl- (aq) afin de diminuer la solubilité du produit organique dans la phase aqueuse. Cette technique s'appelle le relargage ; · laver la phase organique avec de l'eau pour en retirer les espèces solubles dans l'eau ; · extraire le produit de la phase aqueuse avec un solvant organique. |
 |
|
C13c. Ces étapes doivent être suivies de :
|
 |
C14 Etape 3 : la purification.
La purification consiste à éliminer les faibles quantités d'impuretés, contenues dans le produit brut afin d'obtenir le produit purifié.
Les deux méthodes de purification les plus employées sont la recristallisation pour les solides (ex : purification de l’aspirine par recristallisation) et la distillation pour les liquides :
- La recristallisation est une méthode de purification des solides fondée sur la différence de solubilité du produit et des impuretés dans un solvant.
- La distillation est une méthode de purification pour séparer des espèces liquides miscibles.
La distillation est fondée sur les différences de température d'ébullition du produit et des impuretés. Le composé qui distille en premier est le plus volatil (température d’ébullition la plus basse).
C15 Etape 3 : les analyses.
Les étapes d'analyse permettent de contrôler la pureté du produit synthétisé et de le caractériser (de l'identifier).
Il existe plusieurs méthodes, certaines dépendent de l'état physique du produit.
- Pour les solides : mesure de la température de fusion, par exemple, à l'aide du banc Köfler.
- Pour les liquides : mesure de l'indice de réfraction à l'aide d'un réfractomètre ou mesure de la température d'ébullition.
- Pour les liquides et les solides : spectroscopie IR ou de RMN, chromatographies.
|
Utilisation du banc de Köfler :
|
|
C16 Etape 5 : calcul du rendement.
On appelle rendement R de la synthèse le quotient de la quantité de produit effectivement obtenue à la quantité maximale attendue : 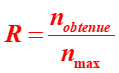 .
.
Dans le cas d'une synthèse en plusieurs étapes, le rendement total est égal au produit des rendements des différentes étapes : 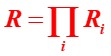
C2 Sélectivité en chimie organique.
Au cours d'une synthèse, l'utilisation de molécules polyfonctionnelles nécessite de nombreuses précautions s'il on ne veut faire réagir qu'un seul groupe fonctionnel : les réactions utilisées doivent alors présenter un caractère sélectif. Elles sont dites chimiosélectives.
C21 Composés polyfonctionnels.
|
La molécule de paracétamol contient deux groupes caractéristiques : amide et hydroxyle |
La molécule de para amino-phénol contient deux groupes caractériqtiques : amine et hydroxyle. |
C22 Réactifs chimiosélectifs.
Un réactif est dit chimiosélectif s'il ne réagit qu'avec un groupe spécifique d'atomes caractéristiques (fonction).
Exemples :
a. Lors de la synthèse du paracétamol, le groupe amine réagit très majoritairement sur l'anhydride d'acide : on dit alors que la réaction est sélective et que l'anhydride d'acide est un réactif chimiosélectif.
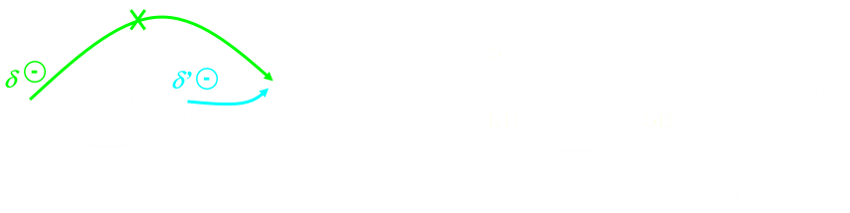
L'atome d'azote du groupe amine et l'atome d'oxygène du groupe hydroxyle sont des sites donneurs de doublet d'électrons.
Dans cet exemple, l'atome d'azote est un meilleur site donneur de doublet que l'atome d'oxygène.
b. Lors de la réaction entre l'aspirine et la soude à température ambiante (doc. ci-contre : réaction acide-base), seule la fonction acide carboxylique réagit : la réaction est sélective.
c. Si l'apirine est chauffée à reflux avec un excès de soude, les deux fonctions réagissent (doc. ci-contre : réaction de saponification) : dans ces conditions la réaction est non sélective.
La sélectivité ou non-sélectivité d'une réaction dépend des réactifs utilisés, mais aussi des conditions expérimentales.
C23 Protection des fonctions.
Lorsqu'il n'est pas possible de mettre en œuvre une réaction sélective pour faire réagir une seule des fonctions d'un composé polyfonctionnel, il faut protéger les autres fonctions.
Un groupe protecteur est un groupe caractéristique, volontairement créé dans la molécule d'un composé polyfonctionnel afin de bloquer la réactivité de l'une de ses fonctions. Cette fonction est temporairement transformée en une autre fonction.
Le groupe protecteur utilisé doit :
- réagir de manière sélective avec la fonction à protéger;
- être stable lors des réactions suivantes;
- pouvoir être enlevé (clivé) facilement et de manière sélective, une fois la réaction effectuée.
L'utilisation d'un groupe protecteur nécessite au moins deux étapes supplémentaires dans une synthèse. Il faut donc que les étapes de protection et de déprotection aient lieu avec de très bons rendements.
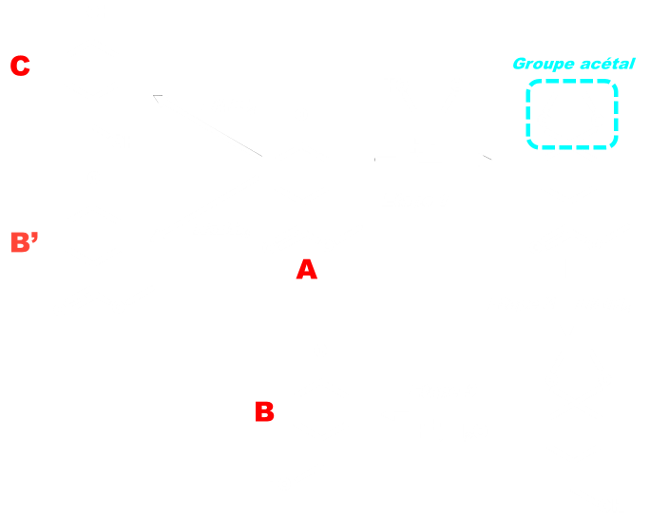
Exemple :
|
- La réduction par LiAlH4 du produit A ci-contre est non sélective, car les deux fonctions, ester et cétone, réagissent et conduisent au produit C. - L'utilisation d'un réactif chimiosélectif tel que NaBH4 ne conduit pas non plus au composé B souhaité, car la cétone, plus réactive que l'ester, est réduite. - Il est donc nécessaire de protéger temporairement la fonction cétone à l'aide d'un groupe acétal, non réactif vis-à-vis de LiAlH4 (étapes 1 à 3). |
 |
C3 Les modifications souhaitées par le chimiste.
|
Pour obtenir une molécule donnée, le chimiste part d'espèces simples ou disponibles dans le commerce. Il choisit la nature et l'ordre des réactions pour réaliser les modifications qu'il envisage, tout en intégrant les critères de :
|
 |
C31 Modification de groupe caractéristique.
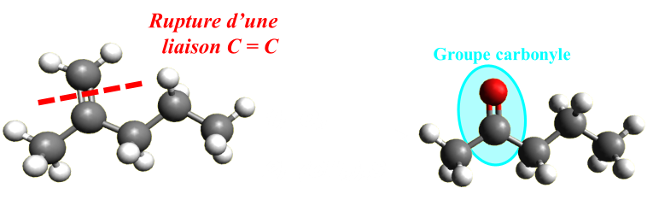
| Le chimiste vise une modification de groupe caractéristique lorsqu'il choisit une transformation permettant d'ajouter, d'enlever ou de remplacer un groupe caractéristique d'une entité chimique, sans modifier la chaîne carbonée. | 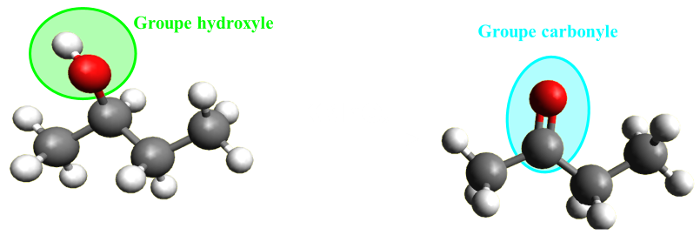 |
C32 Modification de chaîne.
| Le chimiste vise une modification de chaîne lorsqu'il choisit une transformation permettant de modifier la chaîne carbonée d'une entité chimique. Des atomes de carbone peuvent être ajoutés ou enlevés à la chaîne. |
a. b. |
C4 Catégories de réactions.
|
C41. Substitution. Au cours d'une réaction de substitution, un atome ou groupe d'atomes de la molécule étudiée est remplacé par un autre atome ou un autre groupe d'atomes. |
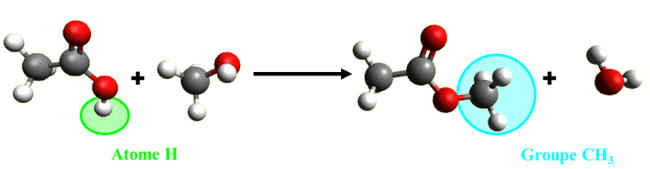 |
|
C42. Addition.
Au cours d'une réaction d'addition, des atomes ou groupes d'atomes se lient à la molécule étudiée sans que celle-ci ne perde d'atomes. |
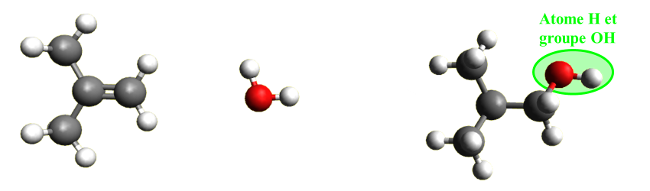 |
|
C43. Elimination. Au cours d'une réaction d'élimination, des atomes ou groupes d'atomes sont ôtés à la molécule étudiée sans que celle-ci ne gagne d'atomes. |
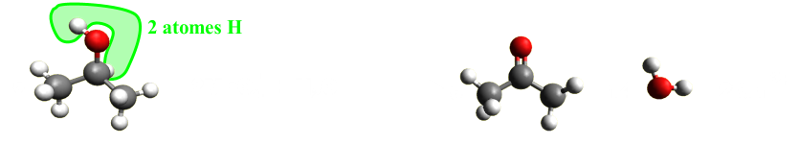 |
C5 Mécanismes réactionnels.
A partir des éléments expérimentaux et théoriques à sa disposition, le chimiste (et physicien) reconstituent le scénario le plus plausible d'une réaction. Ce scénario d'étapes se déroule à l'échelle atomique (aspect microscopique) et traduit les aspects macroscopiques observés.
C51 Polarisation des liaisons.
Une liaison covalente simple est une mise en commun de deux électrons de valence entre deux atomes. Au sein de cette liaison, les deux électrons sont attirés vers l’atome le plus électronégatif et ne sont pas à équidistance des deux atomes. L’atome le plus électronégatif possède un excès d’électrons, représenté par une charge partielle négative δ–. A l’inverse, l’atome le moins électronégatif présente un défaut d’électrons représenté par une charge partielle positive δ+. La liaison est alors dite polarisée.

La polarité d’une liaison se déduit des électronégativités des atomes impliqués. Nous considèrerons que la liaison C–H n’est pas polarisée ; à l’inverse, les liaisons δ+ C–Oδ– et δ+H– Oδ– le sont fortement.
|
|
Position des électrons de la liaison |
Notation |
|
Dihydrogène |
|
|
|
Chlorure d'hydrogène |
|
|
C52 Sites donneurs et accepteurs de doublet d'électrons.
• Un site accepteur de doublet d’électrons est un atome présentant un défaut d’électrons, c’est-à-dire une charge positive partielle δ+ ou une charge positive entière +.
• Un site donneur de doublet d’électrons est, suivant les cas :
- un atome présentant un excès d’électrons, c’est-à-dire une charge négative partielle δ– ou une charge négative entière –
- une liaison multiple
- un atome portant un doublet non liant.
Exemples :
- l'atome H+ est un site accepteur de doublet d'électrons
- l'ion I- est un site donneur de doublet d'électrons.
C53 représentation de mouvement d'un doublet d'électrons.
• Au cours d’une étape d’un mécanisme réactionnel, les mouvements de doublets d’électrons traduisant la formation et la rupture de liaisons chimiques sont représentés par des flèches courbes.
| 1. Un doublet non liant devient un doublet liant. |  |
| 2. Un doublet liant devient un doublet non liant. |  |
| 3. Un doublet liant devient un autre doublet liant. |  |
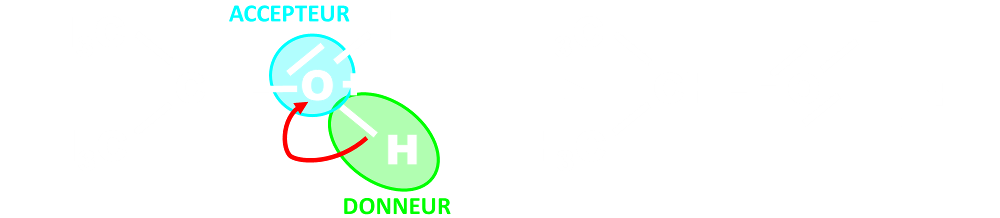
• Lors de la formation d’une liaison covalente, les électrons vont du site donneur vers le site accepteur de doublet d’électrons.
Ce mouvement se représente à l’aide d’une flèche courbe allant du site donneur vers le site accepteur.

• Lors de la rupture d’une liaison covalente, les électrons de la liaison rompue vont vers l’atome le plus électronégatif.
Ce mouvement se représente à l’aide d’une flèche courbe allant de la liaison à rompre vers l’atome le plus électronégatif.
Ajouter un commentaire