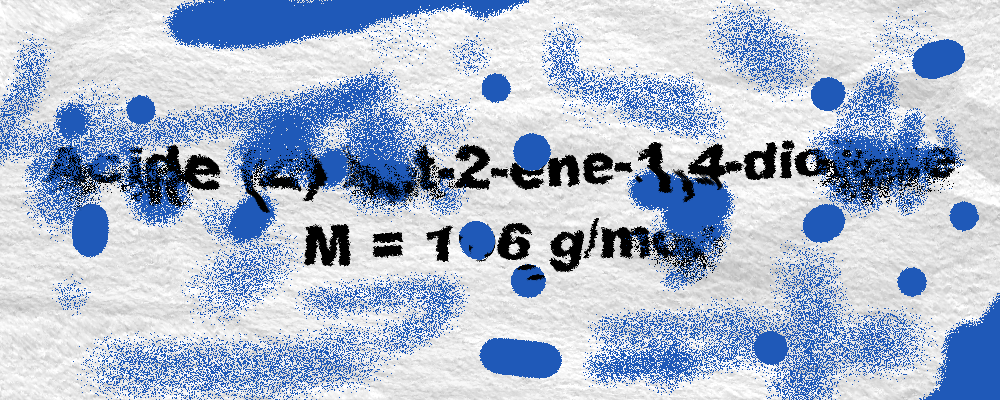Représentation spatiale des molécules
ACTIVITES
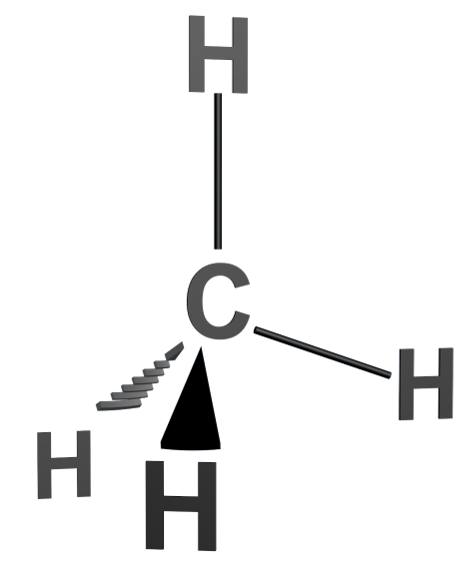
A1 Représentation de Cram
A11 Exemple :
|
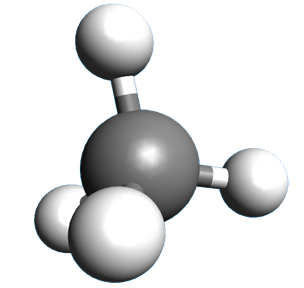
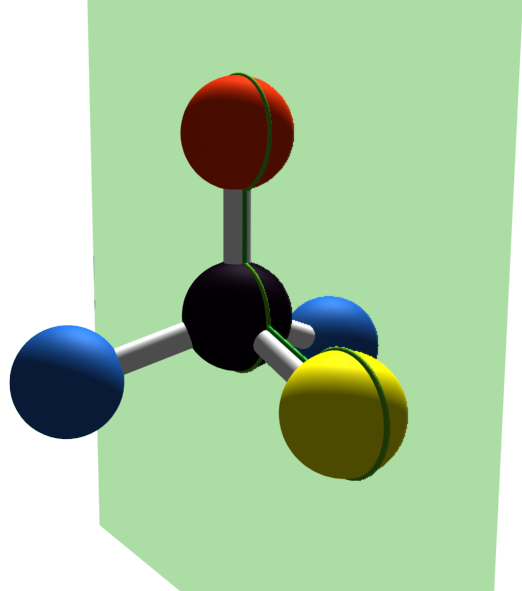
Partons de la molécule de méthane : CH4.
La molécule a une géométrie tétraédrique. Les liaisons C – H sont réparties dans l'espace. Deux liaisons C – H sont forcément dans le même plan. |
La représentation de Cram consiste à :
|
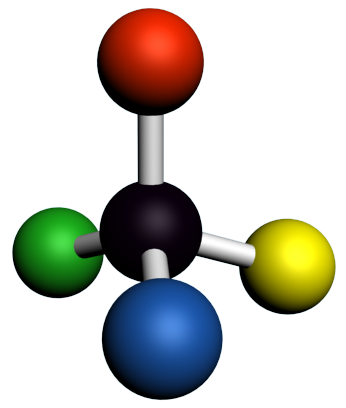
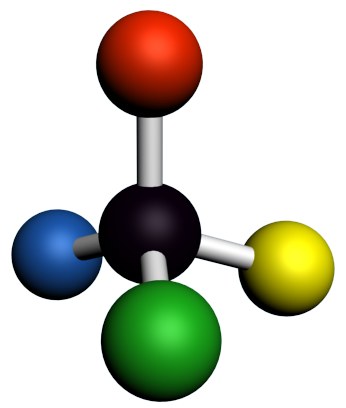
A12 A partir de représentations 3D :
Donner une formule semi-développée de la molécule, puis la représentation de Cram autour de la liaison 1 – 2.
| 1. | 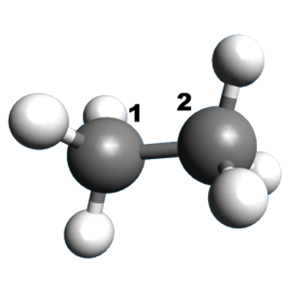 |
2. | 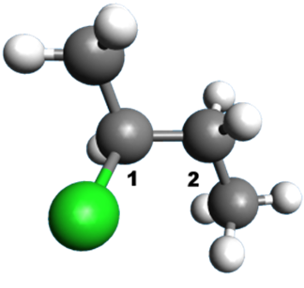 |
3. | 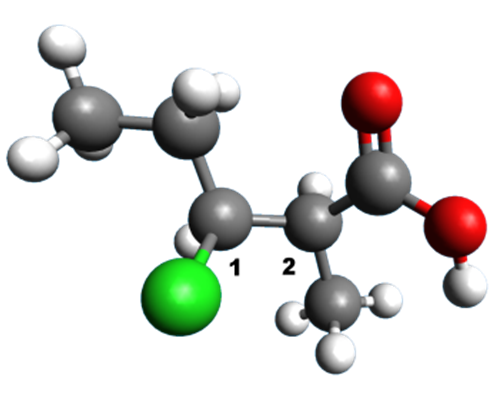 |
4. | 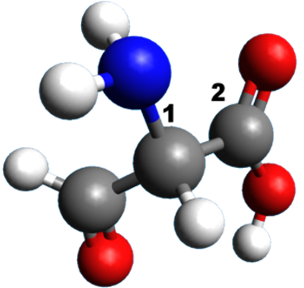 |
A2 Isomérie
A21 Rappel :
Donner la définition du mot isomère.
A22 A partir de la formule brute :
On considère les molécules suivantes : C3H6O ; C4H8 ; C4H10 ; C4H10O ; C6H14.
· Pour chaque molécule donner la représentation topologique et nommer les isomères.
· Qu'est-ce qui différencie ces isomères ? (famille, position)
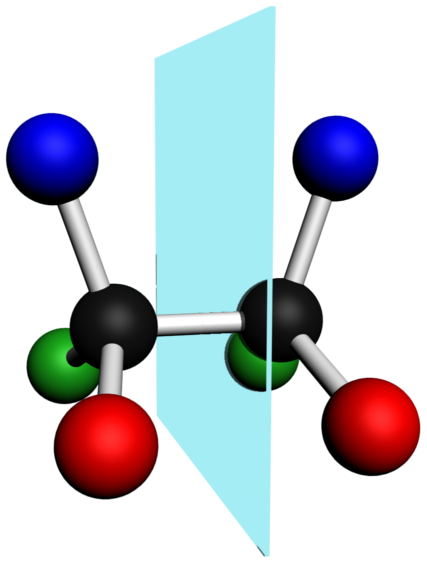
A23 A partir de la semi-développée ou topologique :
· Pour chaque molécule donner la représentation de Cram et nommer les isomères (on placera la liaison rouge dans le plan de la feuille)
· Qu'est-ce qui différencie ces isomères ? (famille, position)
| 1. |  |
2. | 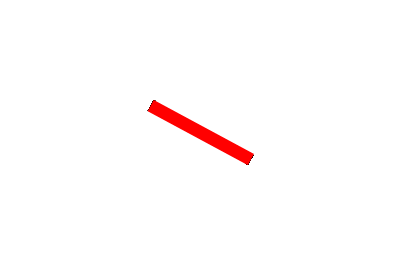 |
3. | 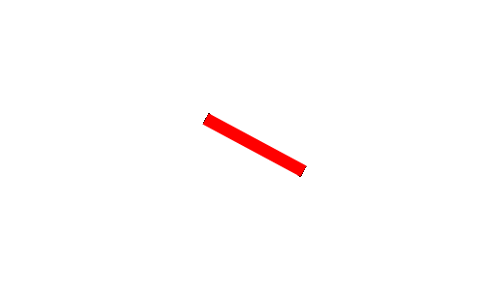 |
A3 Chiralité
A31 Exemples de la vie courante :
Rechercher la définition du mot "chiral".
|
Le clou est un objet achiral |
La vis est un objet achiral |
La main est un objet chiral |
Le méthane est un objet achiral |
Justifier les affirmations ci-dessus.
A32 Application :
Justifier la chiralité des molécules ci-dessous.
 |
 |
 |
 |
A4 Isomérié de configuration.
· Rechercher la définition des termes "stéréoisomère", diastéréoisomère" et "énantiomère".
· Représenter tous les stéréoisomères de la molécule ci-dessous. Donner les relations d'isomérie entre chaque stéréoisomère.

A5 Conformations et énergie.
A51 La molécule d'éthane.
|
|
· A l'aide d'une boite de modèle moléculaire, représenter la molécule d'éthane (modèle éclaté). · Le modèle obtenu est-il le seul ? · Comment expliquer la différence entre les différents modèles obtenus ? · Combien de modèles peut-on obtenir ? · Définir les configurations éclipsée et décalée. · En utilisant la représentation de Cram, représenter les configurations éclipsée et décalée.
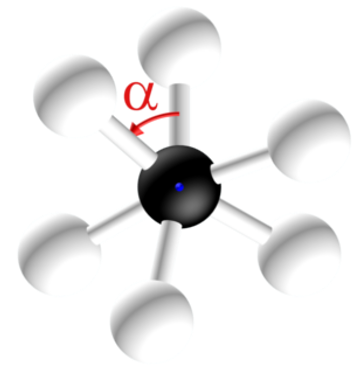
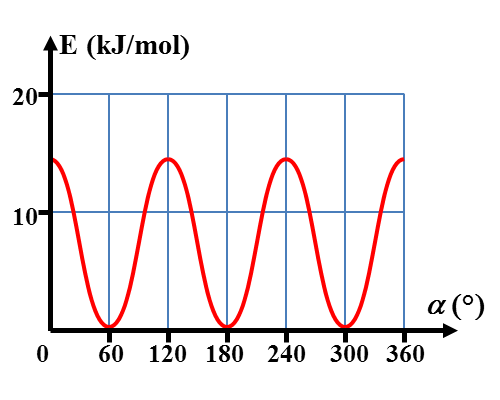
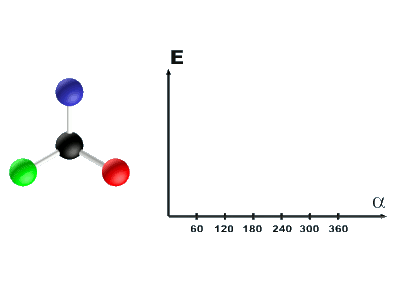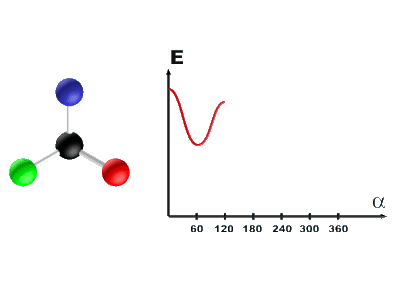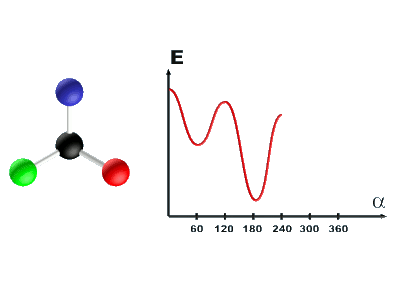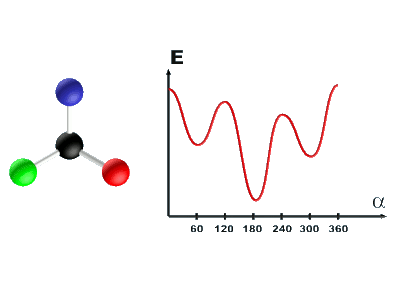
Des analyses conformationnelles permettent de représenter l'évolution de l'énergie de la molécule en fonction de l'angle α. L'origine des énergies est prise pour la configuration la plus stable.
|
· Expliquer les raisons de ces variations énergétiques.
· Déterminer alors quelle est la conformation (éclipsée ou décalée) la plus stable.
A52 La molécule de 1-2, dichloroéthane.
· A l'aide d'une boite de modèle moléculaire, représenter la molécule.
· Donner les représentations (éclipsées et décalées) de Cram.
· Donner l'allure de la courbe énergétique en justifiant votre choix.
A53 La molécule de butane.
Effectuer la même étude que précédemment (l'observateur regarde la molécule dans la direction des deuxième et troisième atomes de carbone).
A6 Propriétés des diastéréoisomères
|
Dans les ruines d'un vieux laboratoire, on a découvert deux flacons contenant des solides blancs. Ils sont rangés dans la catégorie des acides. Mais les étiquettes sont dégradées et une partie des indications a disparu :
Après un début d'étude, on a récolté les informations suivantes : |
 |
| Nom | acide (E)-but-2-ène-1,4-dioïque | acide (Z)-but-2-ène-1,4-dioïque |
| Nom courant | acide fumarique | acide maléique |
| Formule topologique |  |
 |
| Solubilité dans l'eau à 25°C (g/L) | 6,3 | 780 |
| Sécurité | irritant | toxique et irritant |
| Température de fusion (°C) | 287 | 131 |
Comment identifier le contenu de chaque flacon?
A61. A l'aide des premières informations :
A61a. Proposer une formule brute pour chaque molécule.
A61b. Justifier qu'il y ait deux flacons.
A61c. Proposer une formule semi-développée pour chacune.
A62. Proposer différentes expériences permettant de les différencier.
A63. En fonction du matériel disponible, établir le protocole correspondant.
A64. Une fois le protocole validé, le mettre en œuvre et étiqueter les deux flacons correctement.
COURS
C1 Introduction à l'isomérie
C11 Définition.
Deux molécules sont dites isomères si et seulement si :
- Elles ont la même formule brute.
- Et si elles diffèrent :
- Soit par leur formule développée.
- Soit par leur représentation dans l'espace.
Exemple : Le butane de formule brute C4H10 et le méthylpropane, de formule brute C4H10.
 |
 |
C12 Isomérie de chaîne.
Les chaînes principales ne sont pas les mêmes.
C'est le cas dans l'exemple ci-dessus.
C13 Isomérie de position.
C131 Positions des ramifications:
Les chaînes principales sont les mêmes, mais les ramifications ne sont pas positionnées aux mêmes endroits.
Exemple :
|
4-éthyl-2-méthylhexane |
3-éthyl-4-méthylhexane |
C132 Positions des fonctions :
Les chaînes principales sont les mêmes, mais la(es) fonction(s) ne sont pas positionnées aux mêmes endroits.
Exemple :
|
pentan-2-one |
pentan-3-one |
C133 Positions des insaturations :
Les chaînes principales sont les mêmes, mais l'(es) insaturation(s) ne sont pas positionnées aux mêmes endroits.
Exemple :
|
but-1-ène |
but-2-ène |
C14 Isomérie de fonctions.
Les fonctions ne sont pas les mêmes.
|
Exemple : |
butan-2-one |
butanal |
C15 Isomérie d'insaturation.
Les insaturations ne sont pas du même type.
|
Exemple : |
but-2-ène |
cyclobutane |
C16 Autres cas.
Deux molécules peuvent avoir la même formule brute et ne différer que de par leurs structures spatiales.
On parle alors de stéréoisomères.
Il existe deux types de stéréoisoméries :
- La stéréoisomérie de configuration.
- La stéréoisomérie de conformation.
C2 Stéréoisomérie de configuration.
C21 Définition.
Deux stéréoisomères ont la même formule semi-développée, mais des structures spatiales différentes.
Ils sont dits stéréoisomères de configuration s'il faut rompre des liaisons pour passer de l'un à l'autre.
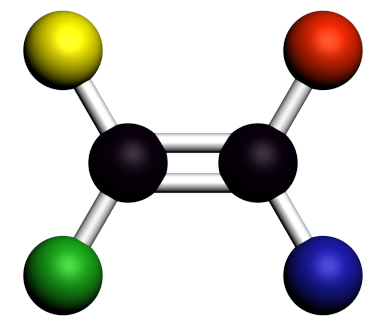
Exemples:
|
|
|
Ces deux composés ont la même formule semi-développée, mais des structures spatiales différentes. Ce sont des stéréoisomères. Il est nécessaire de "casser" une ou plusieurs liaisons pour passer de l'une à l'autre. Ce sont des stéréoisomères de configuration. |
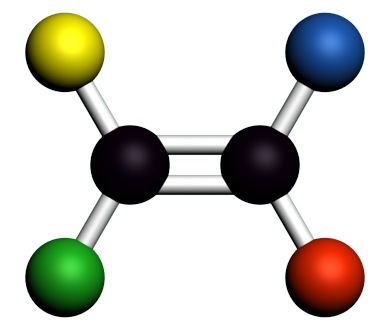
|
|
|
Ces deux composés ont la même formule semi-développée, mais des structures spatiales différentes. Ce sont des stéréoisomères. Il est nécessaire de "casser" une ou plusieurs liaisons pour passer de l'une à l'autre. Ce sont des stéréoisomères de configuration. |
C22 La chiralité.
C221 Définition.
Une molécule est dite chirale si et seulement si elle n'est pas superposable à son image dans un miroir.
|
Cette chaise est un objet achiral : elle est superposable à son image dans un miroir. |
La main est un objet chiral : elle n'est pas superposable à son image dans un miroir. |
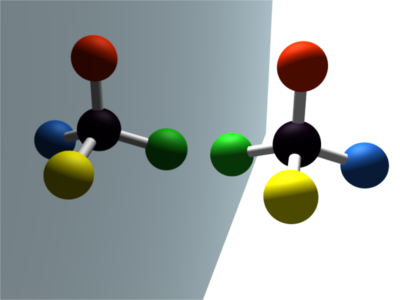 |
Ces deux molécules sont images l'une de l'autre dans un miroir plan. Elles ne sont pas superposables. Ce sont des molécules chirales. La chiralité est due à un carbone asymétrique (portant quatre substituants différents). |
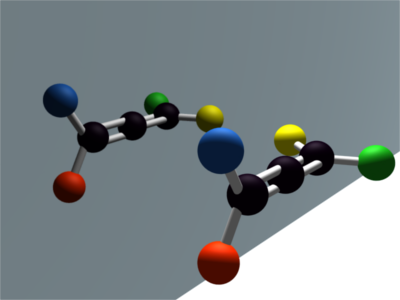 |
Ces deux molécules sont images l'une de l'autre dans un miroir plan. Elles ne sont pas superposables. Ce sont des molécules chirales. La chiralité n'est donc pas forcément due à un carbone asymétrique. |
C222 Condition de chiralité.
Une molécule est dite chirale si et seulement si elle n'est pas identique à elle-même après rotation de 2π/n autour d'un axe suivie d'une symétrie plane.
Exemples:
|
|
|
|
Condition nécessaire mais non suffisante : Si une molécule possède un plan ou un centre de symétrie, elle n'est pas chirale (achirale) |
Condition suffisante, mais non nécessaire : Une molécule possédant un seul carbone asymétrique est une molécule chirale. |
Remarque :
|
Si la molécule possède 2 carbone asymétriques, elle peut être achirale. (ci-contre : deux carbone asymétriques et un plan de symétrie) |
|
C23 Les énantiomères et les diastéréoisomères.
C231 Définitions.
- Deux énantiomères sont deux molécules images l'une de l'autre dans un miroir plan (mais qui ne sont pas superposables)
- Deux diastéréoisomères sont deux molécules stéréoisomères qui ne sont pas énantiomères.
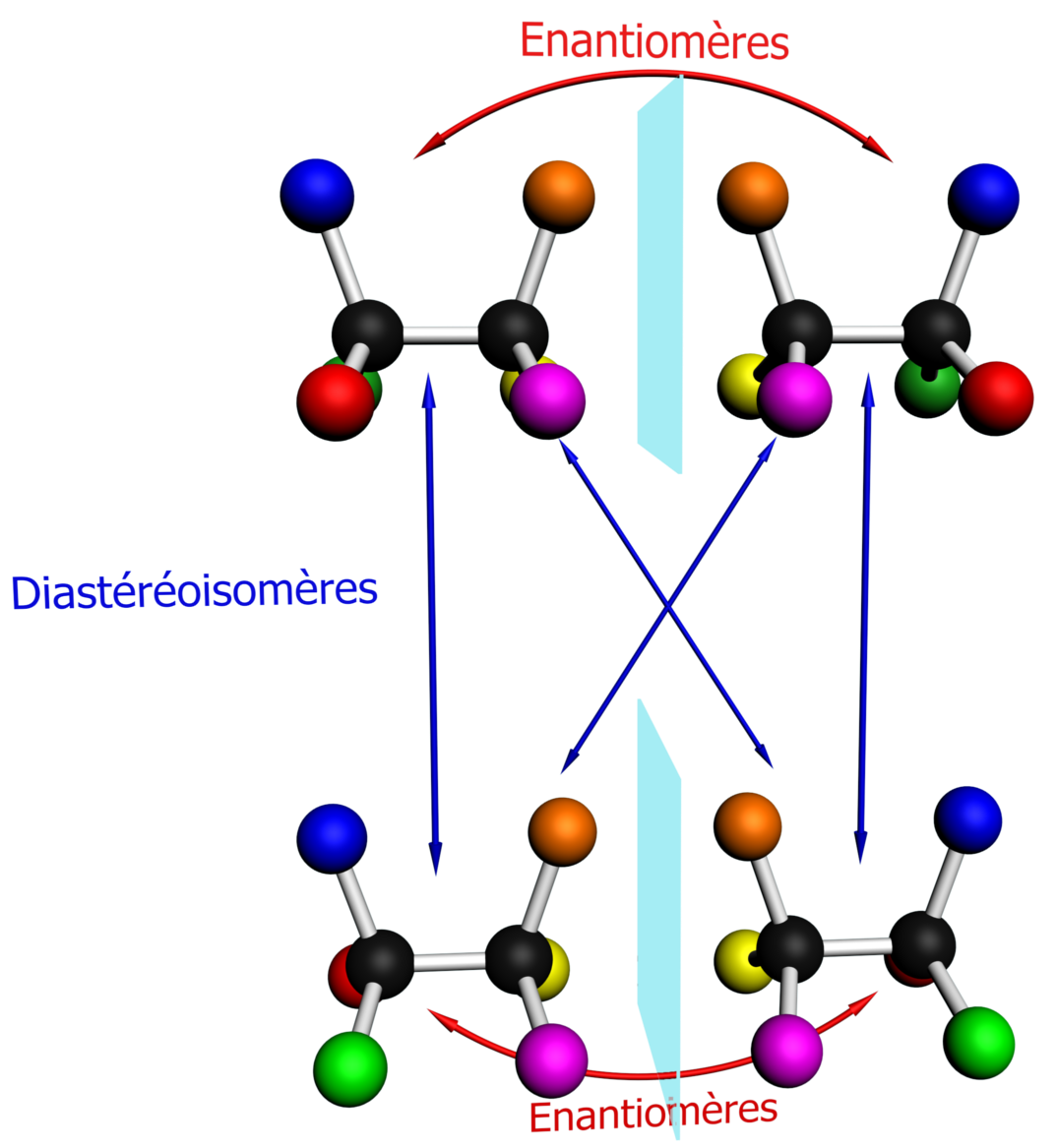 |
Ces quatre molécules sont des stéréoisomères de configuration |
C232 Propriétés comparées d'énantiomères.
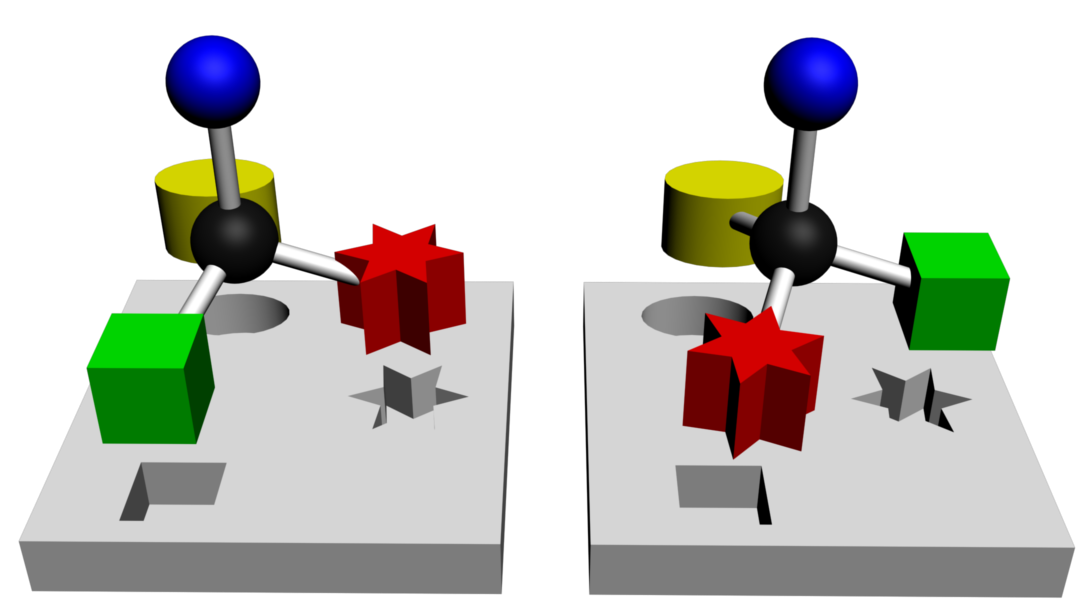 |
|
| L'interaction entre le site récepteur et la molécule est possible. | L'interaction entre le site récepteur et la molécule n'est pas possible. |
C233 Propriétés physiques des énantiomères et des diastéréoisomères.
- Deux diastéréoisomères ont des propriétés physiques différentes (températures de changement d'état, densité…) et sont donc facilement séparables.
- Deux énantiomères ont toutes les propriétés physiques identiques à l'exception de leur pouvoir rotatoire : ils n'interagissent pas de la même façon sur une onde plane polarisée rectilignement.
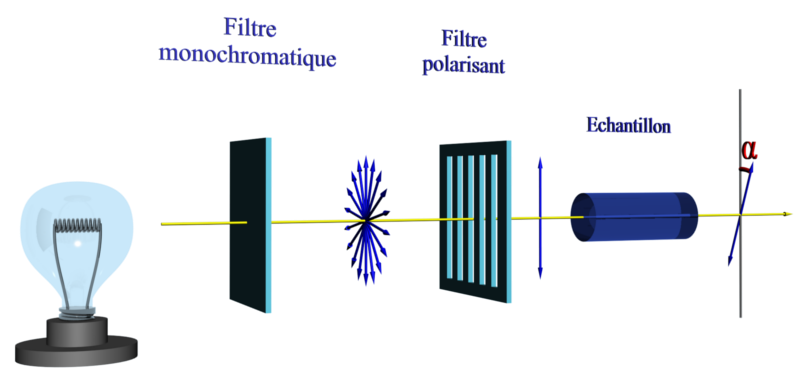
La lumière est déviée d'un angle α pour un énantiomère et d'un angle –α pour l'autre.
Si α = 0, soit la molécule est chirale, soit le mélange est racémique (50% de chaque)
C3 Stéréoisomérie de conformation.
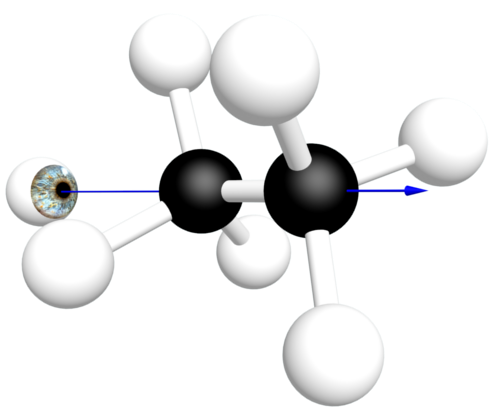
C31 Rotation autour d'une liaison simple.
|
|
Il y a libre rotation autour de la liaison C – C. On obtient ainsi une infinité de conformations pour une même molécule. Les conformations d'une molécule sont les différents arrangements de ses atomes qui peuvent être obtenus sans rupture de liaison. |
Ci-dessous, quelques conformations de la molécule :
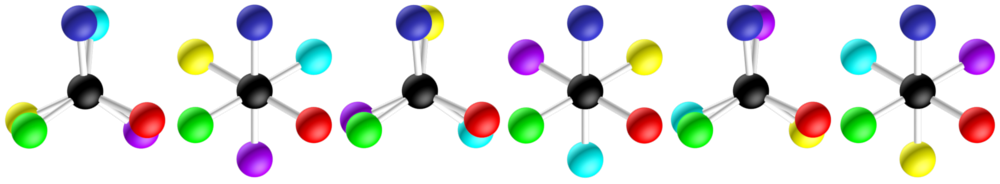 |
|||||
| configuration éclipsée | configuration décalée | configuration éclipsée | configuration décalée | configuration éclipsée | configuration décalée |
C32 Différence d'énergie entre les conformations
- Les répulsions électroniques entre les groupements.
- Les répulsions entre les doublets de liaison (et/ou non liants)
- Gêne stérique.
Ajouter un commentaire