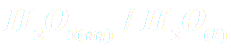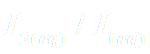Temps et évolution chimique
ACTIVITES
A1 Réactions lentes et rapides
A11 Décoloration du permanganate de potassium
On dispose d'un chronomètre et de quatre solutions :
- Du sulfate de fer II (Fe2+(aq),SO2-(aq)) à la concentration c1 = 5,0.10-1 mol/L.
- De l'acide oxalique (H2C2O4(aq)) à la concentration c2 = 5,0.10-1 mol/L.
- Du permanganate de potassium (K+(aq),MnO-4(aq)) à la concentration c3 = 2,0.10-2 mol/L.
- Du permanganate de potassium acidifié (K+(aq),MnO-4(aq)) à la concentration c4 = 2,0.10-2 mol/L.
Manipulation 1 :
Dans deux béchers A et B, verser la même quantité de sulfate de fer et d'acide oxalique.
Ajouter simultanément 1 mL de permanganate de potassium acidifié dans le deux béchers.
Observer et comparer.
A12 Facteurs de rapidité
A12a. Manipulation 2 :
Reprendre l'expérience précédente avec le permanganate de potassium non acidifié.
Observer, comparer et conclure.
A12b. Manipulation 3 :
Diluer les deux solutions de sulfate de fer et d'acide oxalique 10 fois.
Ajouter simultanément 1 mL de permanganate de potassium acidifié dans le deux béchers.
Observer, comparer et conclure.
A13 Réactions
Les réactions observées sont des réactions d'oxydoréduction faisant intervenir les couples 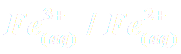
,
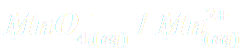
et
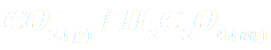
.
Ecrire les demi-équations électroniques et les réactions observées dans chaque bécher.
A2 L'eau oxygénée
Objectif : Mettre en évidence le rôle d'un catalyseur et différencier trois types de catalyses
A21 Nettoyage des lentilles.
Document 1 :
|
|
L'eau oxygénée est couramment utilisée en tant que désinfectant ou décolorant. C'est une solution de peroxyde d'hydrogène H2O2. C'est une solution instable. Composition : Eau oxygénée stabilisée à 30 volumes. Contient environ 9% en poids de peroxyde d'hydrogène. Susceptible de dégager environ 30 fois son volume en dioxygène gazeux. Utilisations : Décolorant puissant, à manipuler avec précaution et sur conseil de votre pharmacien. Précautions d'emploi : Manipuler avec précaution. Ne pas utiliser sur une plaie ou comme produit d'hygiène buccale. Porter des gants appropriés. Eviter le contact avec les yeux. Conserver à l'abri de la chaleur. Péremption : 15 Août 1969 |
Document 2 : NB : la roue est recouverte de platine
A21a. Ecrire la réaction observée.
A21b. Décrire cette réaction.
A21c. Pourquoi le flacon présente-t-il une date de péremption ?
A21d. Reproduire la réaction de la vidéo en introduisant un fil de platine dans quelques mL d'eau
Oxygénée et observer le fil en fin de réaction.
A21e. Quel est le rôle du platine ?
A21f. Comment identifier le gaz formé ?
A21g. Par quel terme peut-on qualifier le platine dans cette réaction ?
A22 A table !!
Document 3 :
|
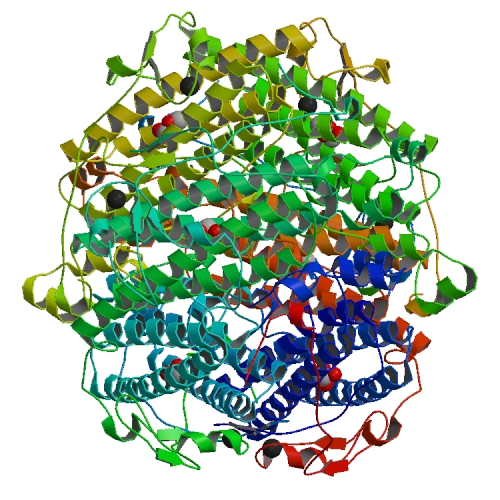
La catalase est une oxydoréductase héminique qui catalyse la dismutation du peroxyde d'hydrogène en eau et en dioxygène. Cette enzyme est formée de quatre chaînes peptidiques d'environ 500 acides aminés. Avec une vitesse maximale de 200.000 réactions catalytiques par seconde, elle une des enzymes les plus efficaces connues. On la trouve dans tous les organismes aérobies et plus particulièrement dans les navets ou dans la plupart des racines des plantes, dans la levure ou le sang.
Structure d'une catalase : |
|
Manipulation :
Mixer la pulpe d'un navet ou d'un radis.
Récupérer quelques gouttes du jus.
Déposer deux gouttes distinctes de peroxyde d'hydrogène sur une lame de verre.
Sur l'une des gouttes déposer du jus.
A22a. Noter vos observations.
A22b. Quel est le rôle de la catalase dans la décomposition du peroxyde ?
A22c. Quelle différence peut-on faire avec l'expérience précédente ?
A22d. Expliquer pourquoi une effervescence est observée si de l'eau oxygénée est versée sur une blessure et pas sur une peau saine.
A23 Une autre décomposition de l'eau oxygénée.
Manipulation :
Prendre trois tubes à essai.
Dans les tubes 1 et 2, introduire 2 mL d'eau oxygénée à 30 volumes.
Dans le tube 3 introduire 2 mL d'eau distillée.
Dans le tube 1, ajouter cinq gouttes de chlorure de sodium.
Dans les tubes 2 et 3, ajouter cinq gouttes d'une solution de chlorure de fer III (Fe3+(aq), 3Cl-(aq)).
Observer pendant 5 minutes.
A23a. Observer pendant 5 minutes.
A23b. Expliquer pourquoi on peut considérer que les ions fer III, bien que non consommés permettent à la réaction d'avoir lieu.
A23c. Qu'en conclure ?
A3 Influence de la concentration, de la température et du solvant
L'ion thiosulfate S2O2-3 se transforme progressivement en milieu acide, selon la réaction :

La formation de particules de soufre solide en suspension opacifie le milieu réactionnel initialement limpide.
Matériel à disposition :
- Solution de thiosulfate de sodium
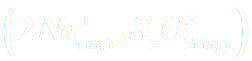 à la concentration c0 = 0,20 mol.L-1.
à la concentration c0 = 0,20 mol.L-1. - Solution d'acide chlorhydrique
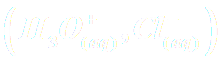 à la concentration ca = 0,10 mol.L-1.
à la concentration ca = 0,10 mol.L-1. - Acétone
- Eau distillée
- Verrerie
- Plaque chauffante
- Glace
- Chronomètre
- Agitateur magnétique
- Thermomètre
- Feuille de papier marquée d'une croix.
Problématique : Comment mettre en évidence l'influence des paramètres "concentration, température, solvant" sur la rapidité de la transformation ?
A3a. Proposer un protocole détailler permettant de mettre en évidence l'influence de chaque paramètre.
A3b. Réaliser.
A3c. Conclure.
A4 Suivi spectrophotométrique
|
Document 1 : Le peroxyde d'hydrogène est un oxydant utilisé pour la désinfection des plaies. En milieu acide, il réagit avec les ions iodure. Les deux espèces appartiennent aux couples d'oxydoréduction : |
|
Document 2:
Ci-contre l'évolution temporelle des quantités de réactifs à 25°C. |
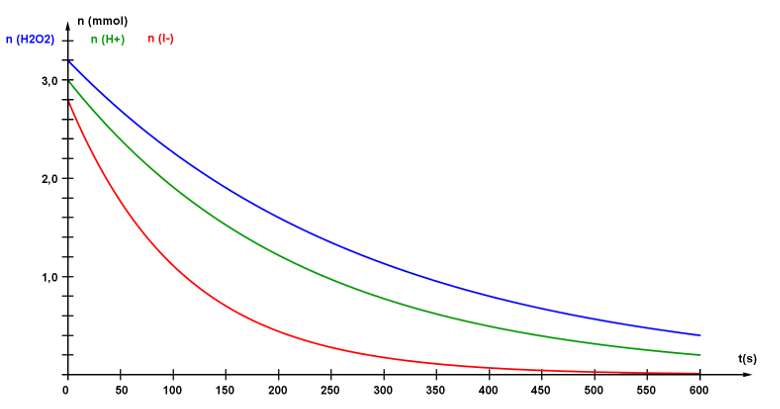 |
|
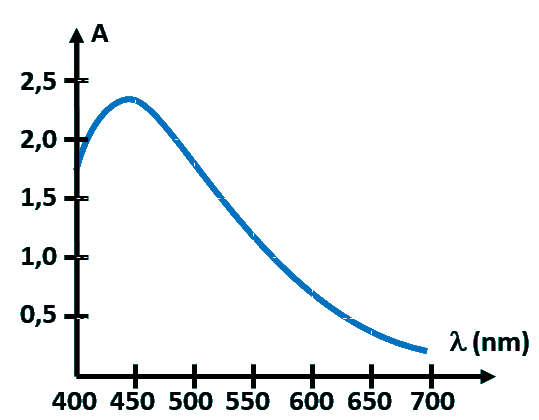
Document 3 : Ci-dessous, la courbe d'absorbance du diiode I2.
|
Document 4: Etalonnage : A partir d'une solution mère aqueuse de diiode à la concentration c0 = 1,5.10-1 mol.L-1, on a réalisé six solutions étalons en introduisant un volume
|
Document 5 : Suivi réactionnel.
· On introduit dans un bécher, un volume V1 = 10,0 mL d'une solution de peroxyde d'hydrogène à la concentration c1 = 3,2.10-1 mol/L.
· On ajoute dans ce bécher un volume V2 =10,0 mL d'une solution acidifiée d'iodure de potassium
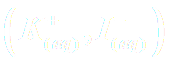 à la concentration c2 = 2,8.10-1 mol/L.
à la concentration c2 = 2,8.10-1 mol/L.
· Rapidement, on déclenche un chronomètre, on introduit dans une cuve spectrophotométrique le milieu réactionnel et on mesure l'absorbance à différents instants.
| t(s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| A | 0 | 0,089 | 0,170 | 0,244 | 0,312 | 0,373 | 0,429 | 0,480 | 0,527 |
| t(s) | 100 | 150 | 200 | 250 | 300 | 350 | 400 | 500 | 600 |
| A | 0,608 | 0,756 | 0,849 | 0,908 | 0,945 | 0,968 | 0,983 | 0,998 | 1,000 |
A41 S'approprier
A41a. Ecrire les 1/2 équations électroniques et l'équation de la réaction étudiée.
A41b. Construire le tableau d'avancement de cette réaction.
A41c. Comment évolue l'absorbance en fonction du temps ? Pourquoi ?
A42 Analyser
A42a. Quel est le réactif limitant ? Justifier.
A42b. A quelle longueur d'onde a-t-on effectué les mesures de l'absorbance ? Justifier.
A42c. Quel est la durée tf de cette réaction ?
A42d. Le temps de demi-réaction t1/2 est le temps au bout duquel la moitié du réactif limitant a été consommée. Déterminer cette valeur et la comparer à tf.
A42e. Quelle est la couleur de la solution en début de réaction ? En fin de réaction ?
A43 Réaliser
A43a. Exprimer l'absorbance A en fonction de [I2].
A43b. Représenter alors [I2] en fonction du temps.
A43c. A l'aide de ce graphe, retrouver la valeur de t1/2.
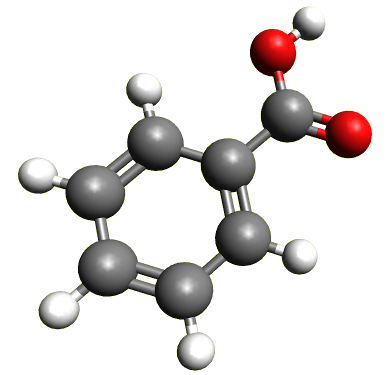
A5 Synthèse d'un conservateur alimentaire : l'acide benzoïque
OBJECTIF:
Mettre en oeuvre un prtocole expérimental pour suivre l'évolution temporelle d'une synthèse organique par CCM et en estimer la durée.
L'acide benzoïque est classé dans la catégorie des conservateurs et figure dans de nombreuses boissons sans alcool, notamment dans les sodas. Son code européen est E210.
La synthèse de l’acide benzoïque se fait par oxydation ménagée de l’alcool benzylique en présence d’un oxydant puissant : l’ion permanganate MnO4 -.
|
Doc1 : les réactions d'oxydation des alcools. On distingue deux types d'oxydations :
On a un changement de groupe caractéristique : · Un alcool primaire est oxydé en aldéhyde, puis en acide carboxylique. · Un alcool secondaire est oxydé en cétone. · Un alcool tertiaire ne s'oxyde pas. |
|
Doc2 : Synthèse de l'acide benzoïque par oxydation ménagée de l'alcool benzylique en présence de l'ion permanganate. L’alcool benzylique est oxydé par l’ion permanganate. Le produit de cette réaction est le benzaldéhyde – un composé aromatique à l’odeur d’amande amère. La réaction se poursuit par oxydation du benzaldéhyde, toujours par l’ion permanganate, pour donner au final l’acide benzoïque. On effectue la synthèse en milieu basique, l'acide benzoïque est alors obtenu sous sa forme basique, à savoir l'ion benzoate de formule C6H5CO2-. Les ions permanganate en milieu basique sont réduits en dioxyde de manganèse, solide marron de formule MnO2.
On peut procéder ensuite à la cristallisation de l’acide benzoïque, on purifie, on filtre puis on sèche le produit obtenu – étape que nous ne réaliserons pas.
Ci-dessous, les représentations topologiques des molécules citées précédemment.
|
|
Document 3 : L'acide benzoïque.
|


Manipulation :
La synthèse nécessite le port de la blouse, de gants et de lunettes.
Les produits sont très inflammables, évitez toute flamme ou étincelle.
|
Matériel :
|
Produits :
|
Préparation des plaques à CCM :
· Préparer 2 plaques à CCM avec sur la ligne de dépôt 4 points équidistants, numérotés de 1 à 8.
· Sur la 1ère plaque, déposer sur le point n°1, une goutte d’alcool benzylique, et sur le point n°2 une goutte de benzaldéhyde pur.
· Préparer la cuve avec l’éluant, et recouvrir cette cuve avec le verre de montre.
Préparation du dispositif de synthèse :
· La synthèse sera réalisée sous agitation et à froid dans un erlenmeyer de 50 mL muni d’un bouchon et d’un tube réfrigérant droit en verre.
· Introduire dans l’erlenmeyer 75 mL d’eau distillée, 10 mL de solution d’hydroxyde de sodium à 0,25 mol.L-1 et 4 g de permanganate de potassium.
· Agiter jusqu’à la dissolution totale du solide.
· Introduire 1 mL d’alcool benzylique, déclencher le chronomètre et faire en même temps un prélèvement et un dépôt sur le point n°3 de la plaque à chromatographie.
· Puis faire un dépôt sur le point n°4 à 1 minute.
· Mettre la plaque en élution.
· Utiliser la deuxième plaque, pour faire des dépôts n°5 à 8 à 2, 4, 6 et 8 minutes.
· Après élution de chacune des plaques faire la révélation sous UV et entourer les tâches obtenues.
A51. A quelles familles appartiennent chacune des molécules du Doc2 ?
A52. Justifier que le suivi cinétique se fasse en milieu basique.
A53. Ecrire l'équation de l'oxydation de l'alcool benzylique en acide benzoïque par l'ion permanganate.
(les couples impliqués sont : 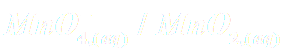 et
et 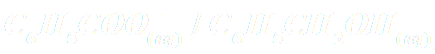
A54. Calculer les quantités de matière d'alcool benzylique introduite et en ions permanganate. En déduire le réactif limitant.
A55. Le réactif limitant doit-il apparaître sur la plaque de chromatographie en fin de réaction ? Justifier.
A56. Reproduire les plaques de chromatographie. Interpréter.
A57. La synthèse de l'acide benzoïque était-elle terminée ? Pouvez-vous en estimer la durée ?
A6 Estimation de la durée d'une réaction chimique.
|
De par son odeur d'amande amère, le benzaldéhyde est utilisé dans l'industrie agroalimentaire et en parfumerie. L'une des méthodes de synthèse est l'oxydation de l'acide benzylique par l'eau de javel. Cette transformation peut être suivie par CCM. Quelle est la durée approximative de cette transformation ? |
|
Doc1 : Protocole
|
· Préparer une plaque de CCM afin de pouvoir y réaliser quatre dépôts. · Dans un erlenmeyer contenant un barreau aimanté, introduire à l'aide d'une pipette graduée 2,0 mL d'alcool benzylique. Dissoudre l'alcool dans 25 mL d'acétate d'éthyle prélevés à l'éprouvette graduée. · Réaliser un premier dépôt de ce milieu réactionnel sur la plaque de CCM. · Ajouter dans l'erlenmeyer environ 40 mL de la solution diluée d'eau de javel et environ 0,6 g de bromure de tétrabutylammonium. Fixer correctement l'erlenmeyer et adapter un réfrigérateur à air, puis mettre en route une agitation vigoureuse. Cette action définit la date t =0. · Aux instants t = 10 min, 20 min et 30 min : arrêter l'agitation et réaliser un dépôt sur la plaque de CCM. (Remettre en route l'agitation) ·Réaliser l'élution en utilisant le dichlorométhane comme éluant. · Révéler la plaque à la lampe à UV, puis entourer les tâches. |
|
Doc2 : Résultat de la CCM
|
|
Données : · Réaction : · Dans les conditions de l'expérience, le réactif limitant est l'alcool benzylique. · Seules les espèces organiques de cette réaction sont révélées par la lampe UV. |
|
Doc 3 : Ion tétrabutylammonium Du fait de ses chaînes carbonnées et de sa charge, l'ion tétrabutylammonium favorise le contact entre l'alcool benzylique soluble en phase organique et l'ion ClO- soluble en phase aqueuse.
|
A61. Mettre en œuvre le protocole.
A62a. Justifier le choix du matériel volumétrique utilisé compte tenu de l'interprétation de l'expérience.
A62b. Attribuer à chaque tache de la CCM à une espèce chimique organique.
A62c. La transformation chimique réalisée est-elle assez lente pour être analysée par CCM ?
A63a. Estimer l'ordre de grandeur de la durée de cette transformation.
A63b. Proposer des changements dans le protocole qui permettraient d'affiner cette estimation.
Ajouter un commentaire